· Половая система
Все клетки организма подразделяют на соматические и половые. После наступления полового созревания развитие мужских половых клеток — сперматозоидов (сперматогенез) совершается в мужских половых железах — яичках, развитие женских половых клеток — яйцеклеток (овогенез) происходит в яичниках — женских половых железах. Зрелые половые клетки — гаметы (cперматозоид и яйцеклетка) способны объединяться и давать начало новому организму. Первичные половые признаки (детерминация пола, закладка гонад и их развитие, некоторые этапы гаметогенезов) определяются при оплодотворении и в эмбриональном периоде, их развитие продолжается в плодном периоде и после рождения. С начала пубертата и вплоть до завершения полового созревания формируются вторичные половые признаки.
Развитие половых желёз
Источники
Источниками половых желёз являются урогенитальные валики и первичные половые клетки.
Урогенитальные валики
Урогенитальные (гонадные) валики — индифферентные гонады — зачатки будущих половых желёз (яичек и яичников). На 4-й неделе эмбриогенеза в грудопоясничном отделе нефротома (на медиальной стороне мезонефроса) формируются гонадные валики, не идентифицируемые ни как мужские, ни как женские половые железы (рис. 15-1). Индифферентные гонады состоят из заселяемого первичными половыми клетками коркового и мозгового вещества.
Рис. 15-1. Гонадные валики (поперечный срез через туловище 4‑недельного эмбриона). В грудопоясничном отделе нефротома формируются гонадные валики — зачатки индифферентных половых желёз. [17]
Первичные половые клетки
Первичные половые клетки возникают, на 2-й неделе эмбрионального развития из клеток головного отдела эпибласта. В ходе гаструляции первичные половые клетки через первичную полоску в энтодерму желточного мешка и далее в гонадные валики (рис. 15-2). В плодном периоде первичные половые клетки дифференцируются в овогонии в развивающихся яичниках или в сперматогонии в яичках. На пути от овогоний или сперматогоний до зрелых гамет различают несколько стадий: размножения, роста, созревания и формирования.
Рис. 15-2. Миграция первичных половых клеток. А — первичные половые клетки среди клеток внезародышевой энтодермы в стенке желточного мешка. Б — на 5‑й неделе эмбриогенеза первичные половые клетки из стенки желточного мешка начинают мигрировать в направлении гонадных валиков (зачатков индифферентных половых желёз). [17]
Половая дифференцировка
Хромосомная детерминация пола происходит при оплодотворении, Y‑хромосома — потенциальная детерминанта генетически мужского пола (рис. 15-3).
Рис. 15-3. Половая дифференцировка. Регуляторный фактор TDF, кодируемый Y-хромосомой, индуцирует в индифферентных гонадах дифференцировку яичек. Гормоны яичек контролируют дальнейшее развитие эмбриона мужского пола. [17]
Фактор детерминации мужских гонад
Фактор, детерминирующий развитие мужских гонад (TDF) — один из индукторов развития мужской половой железы. Регуляторный фактор TDF, кодируемый геном Y-хромосомы SRY (Sex-determining Region Y), ответственен за дифференцировку яичек из изначально бипотентных зачатков гонад.
Индифферентные гонады
Критическая стадия развития индифферентных гонад — 8-я неделя внутриутробного развития. До 45–50 дня зачатки гонад не имеют половой дифференцировки. Под влиянием фактора транскрипции TDF гонадные валики развиваются как яички; при отсутствии эффектов этого фактора развиваются яичники. Дифференцировку других структур определяют мужские половые гормоны и мюллеров ингибирующий фактор (MIF ¾ Mullerian Inhibiting Factor), продуцируемые в яичках плода.
Дифференцировка по мужскому типу. При кариотипе 46XY из клеток мезенхимы гонадного валика дифференцируются интерстициальные эндокринные клетки яичек плода. Под контролем гонадотропинов (хорионического и гипофизарного) интерстициальные эндокринные клетки яичек плода секретируют тестостерон. Экспрессия гена SRY в поддерживающих эпителиальных клетках инициирует транскрипцию гена, кодирующего MIF.
Дифференцировка по женскому типу при кариотипе 46ХХ происходит при отсутствии определяющего развитие яичек фактора Y-хромосомы, андрогенов и MIF. Гонадные валики развиваются как яичники автономно, под влиянием гормонов плаценты.
Яичник и яичко
Дифференцировка яичника и яичка из индифферентных гонад приведена на рисунке 15-4. В женском организме в индифферентных гонадах развивается преимущественно корковое и атрофируется мозговое вещество. В мужском организме преимущественное развитие получает мозговое вещество индифферентной гонады. На 8-й неделе эмбриогенеза яички располагаются на уровне верхних поясничных позвонков. От нижнего полюса яичка вниз тянется поддерживающая связка, выполняющая функцию проводника яичка из брюшной полости через паховый канал в мошонку. Опущение яичек в мошонку завершается приблизительно за 1 месяц до рождения и не происходит при крипторхизме.
Рис. 15-4. Гонады плода. А — яичко на 16-й неделе. Мозговое вещество зачатка гонады дифференцируется в семенные канальцы и сеть яичка. Б — яичник на 20-й неделе. В корковом веществе формируются примордиальные фолликулы. [17]
Крипторхизм (скрытые яички) — отсутствие яичек в мошонке вследствие их неопущения. Среди новорожденных мальчиков крипторхизм обнаруживается в 4%. Но в большинстве случаев яички в течение первого года жизни опускаются в мошонку, а частота крипторхизма у взрослых составляет 0,4–0,8%. Наиболее часто задержка перемещения яичка происходит в паховом канале, реже в брюшной полости. Крипторхизм может быть обусловлен недостаточностью гонадотропных гормонов, нарушением развития яичка, анатомическими пороками на пути миграции яичка (неполное развитие пахового канала, отсутствие наружного пахового кольца, недостаточная длина семенного канатика). Крипторхизм приводит к необратимым нарушениям сперматогенеза или полному его отсутствию. На первом году жизни количество сперматогоний уменьшается на 50%, через 4–5 лет жизни половые клетки исчезают полностью.
Нарушения половой дифференцировки
Истинный гермафродитизм. В половых железах присутствует ткань как яичек, так и яичников. Кариотип: приблизительно в 80% — 46XX, остальные случаи — 46XY или мозаицизм.
Смешанный дисгенез половых желёз наблюдается при кариотипе 45Х/46XY.
Мужской псевдогермафродитизм. Генотип 46XY; имеются яички, но маскулинизация неполная (гипоспадия, микрофаллия, плохо развитая мошонка с яичками или без них). Мужской псевдогермафродитизм наблюдается при множестве эндокринных расстройств (дефекты синтеза тестостерона, его метаболизма и эффектов на клетки-мишени).
Женский псевдогермафродитизм. Генотип 46XX, имеются яичники, но, как правило, мужской фенотип при рождении. Чувствительность ХХ-плода к воздействию андрогенов во время критического периода (8–12 недель внутриутробного развития) приводит к развитию разной степени выраженности губо-мошоночного сращения, формированию урогенитального синуса и увеличению клитора.
Развитие внегонадных половых структур
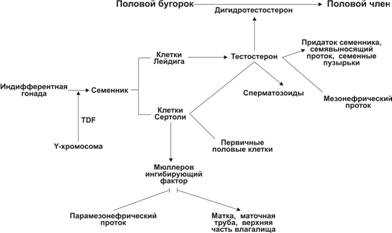
Мужской и женский эмбрионы имеют две пары половых протоков: мезонефрические и парамезонефрические. В каудальном отделе обе пары протоков открываются в мочеполовой синус. Внегонадные половые протоки происходят из мезонефрического и парамезонефрического протоков, наружные половые органы дифференцируются из мочеполового синуса, полового бугорка, половых складок и половых валиков (табл. 15-1 и рис. 15-5).
Рис. 15-5. Дифференцировка женских и мужских половых структур. А — индифферентные гонады. Б — в мужском организме зачатки индифферентных гонад дифференцируются в яички. Мезонефрические протоки в краниальном отделе дифференцируются в придатки яичка, а в каудальном — в семявыносящие протоки и семенные пузырьки. Под действием MIF из яичка потенциально женские парамезонефрические протоки дегенерируют. В — в женском организме зачатки гонад дифференцируются в яичники, а парамезонефрические протоки — в маточные трубы. Слившиеся в каудальном отделе парамезонефрические протоки формируют матку и верхнюю часть влагалища. Мезонефрические протоки дегенерируют. [17]
Мезонефрический проток
Мужской (мезонефрический) проток дренирует первичную почку эмбриона; у мужчин впоследствии развивается в мужские половые структуры. В женском организме (при отсутствии тестостерона) мезонефрические протоки облитерируются. Остатки этих протоков у женщин могут явиться причиной кист шейки матки или влагалища.
Тестостерон
Под влиянием тестостерона, продуцируемого фетальными интерстициальными эндокринными клетками, мезонефрические протоки формируют сеть яичка, придаток, семявыносящие протоки и семенные пузырьки.
Мюллеров ингибирующий фактор
Поддерживающие клетки сперматогенного эпителия семенных канальцев яичек плода секретируют MIF, вызывающий регрессию парамезонефрических протоков у плода мужского пола. Мезенхимные клетки, окружающие парамезонефрический проток, экспрессируют рецепторы MIF и выполняют роль посредников в регрессии парамезонефрического протока. Поддерживающие эпителиальные клетки вырабатывают MIF не только в период дегенерации парамезонефрического протока, незначительные количества MIF синтезируются и после рождения. У женщин MIF секретируется фолликулярными клетками в фолликулярную жидкость (фолликулярные клетки, как и поддерживающие эпителиальные клетки, происходят из бипотентных клеток полового тяжа).
Мутации гена, кодирующего MIF, приводят к билатеральному крипторхизму, паховым грыжам (в грыжевом мешке находятся маточные трубы, матка).
Парамезонефрический проток
Женский (парамезонефрический) проток — трубочка, тянущаяся вдоль первичной почки почти параллельно мезонефральному протоку. В краниальной части парамезонефрические протоки идут раздельно, в каудальном отделе они сливаются в единый проток, открывающийся вместе с мезонефрическими протоками в мочеполовой синус. При отсутствии MIF (даже без поддержки овариальных гормонов) парамезонефрические протоки дифференцируются в маточные трубы (краниальный отдел), матку и верхнюю часть влагалища (каудальный отдел). В мужском организме парамезонефрические протоки подвергаются дегенерации. Дериват парамезонефрического протока может стать источником кистообразной структуры яичка — гидатиды.
Двойная матка. В результате нарушения сращения парамезонефрических протоков в единый формируются две матки, две шейки матки и два влагалища. При недостаточном сращении парамезонефрических протоков может быть две матки, две шейки и одно влагалище, или две матки, одна шейка и одно влагалище.
Таблица 15-1. Дифференцировка структур мочевыделительной и половой систем
|
Мужские половые |
Индифферентные |
Женские половые |
|
Сперматозоиды |
первичные половые клетки |
яйцеклетки |
|
Яичко |
индифферентная гонада |
яичник |
|
сеть яичка, придаток, семявыносящие протоки, семенные пузырьки |
мезонефрический проток |
|
|
|
парамезонефрический проток |
матка, маточные трубы, верхняя часть влагалища |
|
предстательная, бульбоуретральные железы; мочевой пузырь, проксимальная часть уретры |
мочеполовой синус |
нижняя часть влагалища, мочевой пузырь, уретра |
|
половой член |
половой бугорок |
клитор |
|
дистальная часть уретры |
половые складки |
малые половые губы |
|
Мошонка |
половые валики |
большие половые губы |
Наружные половые органы
Наружные половые органы дифференцируются из мочеполового синуса, полового бугорка, половых складок и половых валиков. Уроректальная перегородка разделяет клоаку на дорсальную часть, образующую прямую кишку, и вентральную, называемую мочеполовым синусом. Краниальнее проктодеума образуется эктодермального генеза половой бугорок, на каудальной поверхности которого находится пара половых складок эктодермального происхождения, тянущихся по направлению к проктодеуму. Половой бугорок окружают округлые возвышения — половые валики. Развитие наружных половых органов зависит от половых гормонов.
Тестостерон
В мужском организме под влиянием тестостерона мочеполовой синус даёт начало предстательной и бульбоуретральным железам. 5a-Редуктаза катализирует превращение тестостерона в дигидротестостерон, необходимый для завершающейся к 12–14 неделям внутриутробного развития дифференцировки наружных половых органов (мошонка, половой член).
Дигидротестостерон
Половой бугорок под влиянием дигидротестостерона дифференцируется в половой член, половые складки образуют дистальную часть уретры, а половые валики развиваются в мошонку. При отсутствии андрогенов мочеполовой синус развивается в нижнюю часть влагалища, половой бугорок — в клитор, а половые складки и половые валики дифференцируются в малые и большие половые губы соответственно.
Женские половые гормоны
Эстрогены способствуют дифференцировке органов женской половой системы. При отсутствии андрогенов мочеполовой синус развивается в нижнюю часть влагалища, половой бугорок — в клитор, а половые складки и половые валики дифференцируются в малые и большие половые губы соответственно.
Половое созревание
Нормальное половое созревание (пубертат) происходит при переходе от половой незрелости к взрослому состоянию половой зрелости. Половое созревание инициируется в специальном центре ЦНС, нейроны которого по мере приближения пубертата становятся менее чувствительными к действию половых гормонов. Синтез и секрецию половых гормонов регулирует гормональная цепочка «гонадолиберин гипоталамуса — гонадотропины гипофиза». Изменения в нейрогормональной регуляции секреции гонадолиберина, вызванная секреция гонадотропных гормонов ведут за собой повышение уровня половых стероидных гормонов, обеспечивающих развитие вторичных половых признаков и репродуктивной способности.
Пубертатный период у девочек
Характерные изменения начинаются в возрасте от 8 до 13 лет и происходят в течение 3–4 лет (рис. 15-6).
Развитие молочных желёз, как правило, предшествует формированию лобкового оволосения. Формирование молочных желёз от ювенильной до зрелой завершается к 15 годам.
Галакторея — выделения из молочных желёз вне периода лактации. Необходимо исключить опухоль гипофиза и гипотиреоидизм.
Менархе (начало менструальной функции). Менструации появляются в среднем в возрасте 12,5 лет, кровотечения обычно длятся 4–5 дней. В течение первых двух лет менструальный цикл может быть нерегулярным. У 20% девушек овуляций нет до 17–18 лет.
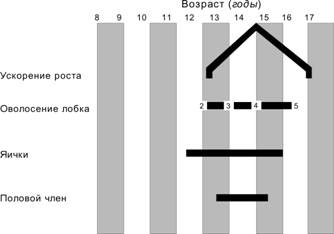
Рис. 15-6. Сроки полового созревания у девушек (средние значения) и длительность стадий (в годах). Скачок роста начинается в возрасте 10,5 лет, достигает пика к 12 годам и заканчивается в 14 лет. 2-я стадия развития лобковых волос начинается примерно в 11 лет. Стадия 3 достигается в 12 лет, стадия 4 — в 13 лет. Стадия 5, при которой развитие лобковых волос соответствует таковому у взрослых, наступает в 15 лет. Молочные железы достигают 2-й стадии развития в 11 лет, 3-й — в 12 лет, 4-й стадии — в 13 лет. Стадия 5 наступает в 15 лет. Менархе наступает в среднем в возрасте 13 лет. [17]
Пубертатный период у мальчиков
Характерные изменения начинаются в возрасте от 9,5 до 13,5 лет и происходят в течение 3 лет (рис. 15-7).
Развитие наружных половых органов. Увеличение яичек и изменение цвета и структуры мошонки обычно являются первым признаком полового созревания. К 15 годам яички и пенис приобретают размеры и форму, характерные для взрослых.
· Пубертатная гинекомастия — развитие молочных желёз у подростков (как правило, одностороннее и в виде субареолярного утолщения, протекает бессимптомно) — встречается у 60% подростков и обычно длится от 6 месяцев до двух лет.
· Варикоцеле — расширение вен семенного канатика — встречается у 15% подростков, чаще с левой стороны.
· Паховая грыжа у мужчин встречается в 5 раз чаще, чем у женщин; располагается, как правило, справа или с двух сторон.
· Гидроцеле — заполненное жидкостью образование в оболочке семенного канатика, расположено в мошонке.
Cперматогенез. Увеличение продукции тестостерона запускает в яичках образование зрелых мужских половых клеток — сперматозоидов.
Сперматоцеле — кистозное образование в составе придатков яичка, содержащее сперматозоиды.
Рис. 15-7. Начало полового созревания (средние значения) у юношей и длительность стадий (в годах). Скачок роста начинается в возрасте 12,5 лет, достигает пика к 14 годам и заканчивается в 16 лет. 2-я стадия развития лобковых волос начинается примерно в 12 лет. Стадия 3 достигается в 13 лет, стадия 4 — в 14 лет. Стадия 5, при которой развитие лобковых волос соответствует таковому у взрослых, наступает в 15–16 лет. Яички начинают развиваться в возрасте 11,5 лет. Созревание продолжается до 15 лет. Развитие пениса: от 12,5 лет до 14,5 лет. [17]
Нарушения полового созревания
Задержка полового созревания
Девочки. По определению, задержкой считается отсутствие вторичных половых признаков к 14-летнему возрасту, а также отсутствие менструаций к 16-летнему возрасту при наличии вторичных половых признаков (первичная аменорея).
Мальчики. Отсутствие признаков полового созревания к 14-летнему возрасту считается задержкой.
Преждевременное половое созревание
Половое созревание считается преждевременным, если какой-либо из вторичных половых признаков появляется у девочек ранее 7,5 лет, а у мальчиков ранее 9 лет. Истинное (центральное, зависящее от гонадотропинов) преждевременное половое созревание чаще встречается у девочек, чем у мальчиков.
· Преждевременное развитие молочных желёз выявляется довольно часто. Обычный возраст их возникновения — 12–24 месяца. Преждевременное развитие молочных желёз связано с транзиторным выбросом эстрогенов из яичников препубертатного периода или в связи с повышенной чувствительностью к низким дозам эстрогенов.
· Преждевременное формирование вторичных половых признаков. Раннее появление оволосения на лобке (у девочек — до 8 лет, у мальчиков — до 9 лет). Это доброкачественное состояние связывают с ранним созреванием секреции андрогенов надпочечниками (адренархе) у некоторых детей.
· Преждевременное изосексуальное половое созревание. Различают два подтипа — гонадотропин-зависимое и гонадотропин-независимое.
В гонадах мужские и женские половые клетки проходят все стадии гаметогенеза.
Стадии размножения и роста
Сперматогенез
Первичные половые клетки мигрируют в зачатки гонад, делятся и дифференцируются в сперматогонии. До периода полового созревания сперматогонии остаются в состоянии покоя. Стадия размножения начинается с наступлением половой зрелости. До этого момента секреция тестостерона поддерживается на низком уровне. По мере приближения половой зрелости в гипоталамусе усиливается синтез гонадолиберина, активирующего секрецию гонадотропных гормонов аденогипофиза. Под влиянием лютеинизирующего гормона интерстициальные эндокринные клетки яичка увеличивают синтез тестостерона, инициирующего сперматогенез. После ряда митотических делений сперматогонии дифференцируются в сперматоциты первого порядка, вступающие в стадию роста.
Овогенез
В претерпевающих дифференцировку яичниках овогонии вступают в стадию размножения. К 7‑му месяцу внутриутробного развития овогонии прекращают деление и дифференцируются в овоциты первого порядка. Завершив стадию роста, овоциты первого порядка в профазе первого деления мейоза приобретают оболочку из фолликулярных клеток (образуется примордиальный фолликул) и вступают в длительный период покоя, вплоть до наступления половой зрелости. Количество овоцитов первого порядка в 7 месяцев — до 10 миллионов, при рождении — около 2 миллионов.
Стадия созревания
Стадия созревания следует сразу за стадией роста.
Сперматогенез
В результате двух делений мейоза образуются четыре сперматиды, имеющие по 22 аутосомы и одной X- или Y-хромосоме. При кроссинговере известны случаи транслокации генов из хромосомы Y в хромосому Х.
Овогенез
С наступлением половой зрелости и установлением овариально-менструального цикла на пике лютеинизирующего гормона завершается первое деление мейоза. Сигнал для завершения второго мейотического деления — оплодотворение, овоцит второго порядка делится с образованием зрелой яйцеклетки и второго полярного (направительного) тельца. Зрелая яйцеклетка имеет 22 аутосомы и одну X–хромосому (рис. 15-8).
Рис. 15-8. Мейоз включает два последовательных деления. Перед первым делением генетический материал удваивается с образованием конъюгированных хромосом (2n2c). После первого деления мейоза в дочерних клетках уменьшаются количество хромосом и содержание ДНК; остаётся по 23 конъюгированных (удвоенных) хромосомы с диплоидным содержанием ДНК (1n2c). После второго деления мейоза дочерние клетки получают по 23 хромосомы с гаплоидным содержанием ДНК (1n1c) — 22 аутосомы и одну половую хромосому. n — число хромосом, c — количество ДНК. [17]
Аномалии хромосом
Хромосомные нарушения возникают в мейозе овогенеза или сперматогенеза de novo, поэтому родители могут быть здоровы по этому признаку.
Аномалии числа хромосом возникают вследствие нерасхождения хромосом в мейозе (рис. 15-9).
· Половые хромосомы. Синдром Тернера (45Х0) встречается с частотой 1:2500, синдром Кляйнфелтера (47ХХY) ¾ 1:1000, 47ХХХ ¾ 1:1000, 47ХYY ¾ 1:1000.
· Аутосомы. Синдром Дауна (трисомия 21) встречается с частотой 1:700, синдром Эдвардса (трисомия 13) ¾ 1:4000), синдром Патау (трисомия 18) ¾ 1:8000.
Рис. 15-9. Нерасхождение хромосом в мейозе. [150]
Аномалии структуры хромосом. В ходе кроссинговера в хромосомах, обменивающихся гомологичными участками, возникает перераспределение или утеря части генного материала: инверсии, делеции, дупликации, транслокации.
Транслокация гена SRY, кодирующего TDF, из Y-хромосомы в X–хромосому в ходе кроссинговера приводят к изменению пола и дисгенезии гонад. В случае оплодотворения яйцеклетки сперматозоидом с Y-хромосомой, утратившей ген SRY, генетические мужчины (46XY) имеют женский фенотип и, наоборот, при оплодотворении яйцеклетки X–хромосомой, получившей ген SRY, генетические женщины (46XX) имеют мужской фенотип.
Пренатальная диагностика. Исследование кариотипа клеток, полученных при амниоцентезе или биопсии ворсин хориона.
Стадия формирования
Стадия формирования гамет заключается в морфологической дифференцировке сперматид и образовании сперматозоидов. Эта стадия отсутствует в овогенезе.
Герминогенные опухоли
Трансформированные незрелые половые клетки способны к дифференцировке в различные клеточные типы. Степень и направление дифференцировки варьируют. Встречаются опухоли, состоящие из соматических (тератомы), внезародышевых (опухоли желточного мешка) и недифференцированных клеток (семиномы).
· Семинома — наиболее часто встречаемая герминома у мужчин в возрасте от 20 до 40 лет. Диагностическим маркёром неоплазмы служит 12 хромосома с удвоенным коротким плечом. В крови больных повышается уровень хорионического гонадотропина.
· Тератокарцинома яичка происходит из зародышевых клеток, трансформированных до наступления мейоза или на его раннем этапе, поэтому в начальной стадии опухоль напоминает эмбрион с тремя первичными зародышевыми листками (мужская беременность). На поздней стадии в тератокарциноме обнаруживаются производные всех трёх зародышевых листков: железы (из энтодермы), хрящ (из мезодермы), многослойный плоский эпителий, волосы (из эктодермы). В крови больных выявляется повышенный уровень a-фетопротеина.
Мужская половая система состоит из половых желёз (яички), комплекса половых протоков (выносящие канальцы, проток придатка, семявыносящий проток, семявыбрасывающий проток), добавочных желёз (семенные пузырьки, предстательная железа, бульбоуретральные железы) и полового члена.
Яички (testis), в отличие от яичников, располагаются вне полости тела (в мошонке). Это обстоятельство важно для нормального течения сперматогенеза, происходящего при температуре 34 °C и ниже. Снаружи яичко покрыто соединительнотканной белочной оболочкой (t. albuginea) (рис. 15-10). Внутренний её слой богат кровеносными сосудами — сосудистая оболочка (t. vasculosa). Утолщение белочной оболочки, вдающееся с одной стороны в паренхиму яичка, называется средостением (mediastinum testis). От средостения внутрь яичка отходят перегородки, разделяющие его на дольки конической формы. Каждая долька содержит от одного до четырёх извитых семенных канальцев (tubulus seminifer contortus), выстланных сперматогенным эпителием (epithelium spermatogenicum). В рыхлой соединительной ткани между семенными канальцами расположены интерстициальные эндокринные клетки (endocrinocytus interstitialis). По мере приближения к средостению семенные канальцы продолжаются в прямые (tubuli recti). Их стенка образована кубическим эпителием и базальной мембраной, окружённой тонкой соединительнотканной оболочкой. Прямые канальцы впадают в сеть яичка (rete testis) — систему анастомозирующих тонкостенных трубочек, продолжающихся в выносящие канальцы придатка. Эпителий, выстилающий сеть яичка, представлен кубическими клетками. Некоторые клетки на апикальной поверхности имеют по одной ресничке, способствующей продвижению сперматозоидов. Под базальной мембраной эпителия располагается рыхлая соединительная ткань, окружающая трубочки rete testis снаружи. Генеративная функция (сперматогенез, spermatogenesis) осуществляется в извитых семенных канальцах, а эндокринная (синтез мужских половых гормонов) — в интерстициальных эндокринных клетках.
Рис. 15-10. Яичко с придатком. А — соединительнотканная строма яичка и придатка. Б — паренхима яичка и придатка. [17]
интерстициальные эндокринные клетки
Клетки расположены в рыхлой волокнистой соединительной ткани между семенными канальцами. Это типичные эндокринные клетки, синтезирующие мужские половые гормоны стероидной природы (андрогены). Для этих клеток характерны развитая гладкая эндоплазматическая сеть, многочисленные митохондрии, жировые включения.
Андрогены
Андрогены — мужские половые гормоны. Существует несколько стероидов с андрогенной активностью. Интерстициальные эндокринные клетки синтезируют 95% циркулирующего в крови тестостерона, дигидротестостерон и предшественник тестостерона андростендион (обладает слабой андрогенной активностью) (рис. 15-11).
Рис. 15-11. Биосинтез тестостерона. Тестостерон синтезируется из холестерина, поступающего в клетку в составе ЛНП, через опосредованный рецептором эндоцитоз Из цитоплазмы холестерин с помощью белка-переносчика стеринов SCP-2 (Sterol Carrier Protein-2) транспортируется в митохондрию. Десмолаза митохондрий катализирует образование из холестерина прегненолона, который транспортируется обратно в цитоплазму. Ферменты, участвующие в дальнейшем синтезе тестостерона, локализуются в цитозоле, гладкой эндоплазматической сети или митохондриях. В клетках-мишенях тестостерон может быть конвертирован в дигидротестостерон, эстрадиол или андростендион. [82]
· Тестостерон — (17b)-17-гидроксиандрост-4-ен-3-он, C19H28O2, мол. масса 288,43 — основной циркулирующий андроген, суточная секреция — 5 мг. До наступления половой зрелости содержание тестостерона в крови весьма низко.
· Андростендион с помощью 17b-гидроксистероид-дегидрогеназы конвертируется в тестостерон в интерстициальных эндокринных клетках яичка и клетках-мишенях.
Мутация гена 17b-гидроксистероид-дегидрогеназы характеризуется нарушением синтеза тестостерона. В крови повышено содержание андростендиона (субстрата дефектного фермента). Клинически у новорождённого выявляются микрофаллия (гипоплазия полового члена), гипоспадия (нижняя расщелина уретры со смещением наружного отверстия мочеиспускательного канала на вентральную поверхность пениса, в мошонку или промежность).
· Дигидротестостерон образуются из тестостерона при помощи фермента 5a-редуктазы в интерстициальных эндокринных клетках и клетках-мишенях (например, в простате, семенных пузырьках). Гормон необходим для дифференцировки наружных половых органов (мошонка, половой член) и предстательной железы. Этот анаболический стероид запрещён законодательством ряда стран к применению (кроме диагностических целей).
Мутация гена 5a-редуктазы. Ребёнок рождается с минимальными проявлениями вирилизации наружных половых органов. Клинически дефицит 5a-редуктазы не отличим от недостаточности 17b-гидроксистероид-дегидрогеназы.
· Ароматизация тестостерона. В печени и жировой ткани из тестостерона с помощью Р450 ароматазы образуется основное количество эстрадиола.
Транспортные белки (b-глобулин и альбумин) связывают в крови до 99% тестостерона. Андрогенсвязывающий белок отвечает за поддержание высокого уровня тестостерона в сперматогенном эпителии путём накопления тестостерона в просвете семенных канальцев.
Рецептор андрогенов (ген AR) относится к ядерным, содержит ДНК–связывающую область. Известно множество мутаций, приводящих к полной или частичной нечувствительности мишеней к андрогенам.
Синдром тестикулярной феминизации (популяционная частота 1:20 000). При полной резистентности к андрогенам ребёнок имеет кариотип 46ХY, но внешне выглядит как несомненная девочка. Влагалище завершается слепым карманом, имеются гипопластические мужские протоки вместо фаллопиевых труб и матки; яички расположены в брюшной полости, паховом канале или в больших половых губах. Эндогенный эстроген, синтезируемый в яичках, стимулирует развитие молочных желёз в период полового созревания.
Функции. В эмбриогенезе андрогены контролирует развитие плода по мужскому типу. В период полового созревания они обеспечивают становление физических признаков мужского пола (оволосение по мужскому типу, огрубение голоса, рост мышечной массы), поддерживают рост хряща, стимулируют закрытие эпифизарных пластинок. С наступлением половой зрелости тестостерон необходим для поддержания сперматогенеза. Железистые клетки добавочных желёз чувствительны к андрогенам. Тестостерон стимулирует рост и секреторную активность предстательной железы, семенных пузырьков и бульбоуретральных желёз.
Деградация андрогенов. В печени метаболиты гормонов соединяются с глюкуроновой кислотой и далее выводятся с мочой.
Лютеинизирующий гормон
Лютеинизирующий гормон (лютропин) — стимулятор синтеза андрогенов интерстициальными эндокринными клетками яичка. В мембране этих клетки лютеинизирующий гормон взаимодействует с рецептором, связанным с G–белком, активирующим аденилатциклазу. Увеличение в цитозоле цАМФ стимулирует протеинкиназу А (РКА), регулирующую экспрессию SCP (Sterol Carrier Protein), SAP (Sterol-Activating Protein) и ферментов синтеза тестостерона.
Извитые семенные канальцы
Извитые семенные канальцы(рис. 15-12) выстланы сперматогенным эпителием, содержащим клетки двух типов — гаметы с их предшественниками на различных стадиях дифференцировки (сперматогонии, сперматоциты первого порядка, сперматоциты второго порядка, сперматиды, сперматозоиды) и поддерживающие эпителиальные клетки (сустентоциты) (рис. 15-12А). Снаружи канальцы окружены тонкой соединительнотканной оболочкой. Извитые семенные канальцы открываются в прямые, по которым сперматозоиды попадают в сеть яичка.
Рис. 15-12. Извитые семенные канальцы. Канальцы выстланы сперматогенным эпителием (1). Между канальцами видны крупные интерстициальные эндокринные клетки (2). В просвете канальцев (3) находятся сперматозоиды. Окраска гематоксилином и эозином.
Рис. 15-12А. Сперматогенный эпителий. На базальной мембране располагаются поддерживающие эпителиальные клетки, а также сперматогонии типов А и В. Ближе к просвету канальца лежат сперматоциты первого и второго порядков, над которыми находятся сперматиды на различных этапах развития и сперматозоиды. [17]
Сустентоциты
Широкое основание сустентоцитов (sustentocytus, поддерживающих эпителиальных клеток) находится на базальной мембране, а суженная складчатая апикальная часть достигает просвета канальца. При помощи плотных контактов сустентоциты делят сперматогенный эпителий на базальное и адлюминальное пространства. В базальном пространстве находятся только сперматогонии. В адлюминальном пространстве располагаются сперматоциты первого и второго порядков, сперматиды и сперматозоиды (см. рис. 15-12). Между сустентоцитами и гаметами устанавливаются адгезионные и щелевые контакты (рис. 15-13). Сустентоциты оказывают физическую поддержку развивающимся гаметам, обеспечивают их питательными веществами (трофическая функция), поглощают продукты метаболизма, фагоцитируют остатки цитоплазмы формирующихся сперматозоидов (резидуальные тельца) и дегенерирующие половые клетки, секретируют жидкость для транспорта сперматозоидов в семенных канальцах.
Гематотестикулярный барьер. Поддерживающие клетки в период полового созревания вблизи базальной мембраны образуют плотные контакты, формирующие гематотестикулярный барьер. Благодаря такому барьеру, в адлюминальном пространстве создаётся специфическая гормональная среда с высоким уровнем тестостерона. Барьер изолирует созревающие половые клетки от токсических веществ и препятствует развитию аутоиммунного ответа против поверхностных Аг, экспрессирующихся на мембране созревающих сперматозоидов.
Рис. 15-13. Типы и локализация межклеточных контактов в сперматогенном эпителии. Сустентоциты связаны плотными, адгезионными и щелевыми контактами. Между поддерживающими эпителиальными клетками в их базальной части локализуются плотные контакты, отвечающие за формирование гематотестикулярного барьера. В апикальной части клетки связаны щелевыми контактами. В плотных контактах молекулы адгезионного контакта JAM, окклюдины и клаудины через ZO-1 и ZO-2 взаимодействуют с актином. Между сустентоцитами и гаметами устанавливаются адгезионные и щелевые контакты. [43]
Продукты секреции. В кровь сустентоциты секретируют эстрогены, ингибин, мюллеров ингибирующий фактор MIF (в плодном периоде). В адлюминальном пространстве поддерживающие эпителиальные клетки накапливают андроген-связывающий белок, фактор стволовых клеток, трансферрин, активаторы плазминогена.
· Андрогенсвязывающий белок — фактор, обеспечивающий поддержание высокой концентрации тестостерона в сперматогенном эпителии путём накопления гормона в просвете семенных канальцев.
· Фактор стволовых клеток (SCF) необходим для сохранения популяции сперматогоний.
· Трансферрин, кроме транспорта железа в сперматогенный эпителий, является мощным митогенным фактором.
· Протеазы (катепсины, активаторы плазминогена) и ингибиторы протеаз (серпины, цистатины) влияют на протеолитические реакции, что важно для миграции созревающих половых клеток из базального пространства в адлюминальное.
Фолликулостимулирующий гормон (фоллитропин) — главный стимулирующий фактор сустентоцитов. Рецепторы фолликулостимулирующего гормона, относятся к связанным с G–белком, активирующим аденилатциклазу. Увеличение в цитозоле цАМФ повышает секреторную функцию поддерживающих эпителиальных клеток.
Сперматогенез
Сперматогенез (путь от сперматогонии до сперматозоида) в извитых семенных канальцах длится 65 дней, но окончательная дифференцировка сперматозоидов происходит в протоке придатка яичка в течение следующих двух недель. Только в области хвоста придатка сперматозоиды становятся зрелыми половыми клетками и приобретают способность к самостоятельному передвижению и оплодотворению яйцеклетки. Сперматогенез подразделяют на стадии размножения, роста, созревания и формирования. На стадии размножения выделяют сперматогонии типов А и В (рис. 15-12).
Сперматогонии типа А
Среди сперматогоний типа А по степени конденсации хроматина различают тёмные и светлые клетки. Тёмные сперматогонии считаются резервными стволовыми клетками, редко вступающими в митоз. Светлые сперматогонии — полустволовые клетки, находящиеся в непрерывно следующих друг за другом клеточных циклах (интерфаза сменяется митозом). В результате деления светлой клетки типа А образуются либо две клетки типа В (симметричный митоз), либо одна клетка типа В и одна светлая клетка типа А (асимметричный митоз).
Сперматогонии типа В
Сперматогонии типа В имеют круглое ядро и конденсированный хроматин. Они также вступают в митоз, но при этом остаются связанными друг с другом при помощи цитоплазматических мостиков. После ряда митотических делений сперматогонии типа В дифференцируются в сперматоциты первого порядка, которые из базального пространства перемещается в адлюминальное и вступают в стадию роста. В стадии роста объём сперматоцитов первого порядка увеличивается в 4 и более раз.
Клеточные ассоциации
На стадиях размножения, роста и созревания сперматогенные клетки входят в состав клеточных ассоциаций (рис. 15-14). Светлая сперматогония типа А формирует клон сперматогенных клеток (синцитий), в котором клетки остаются связанными цитоплазматическими мостиками до стадии формирования. Клеточная ассоциация в своем развитии от сперматогоний до сперматозоидов проходит шесть стадий (I–VI), для каждой из которых существует характерный тип сочетания сперматогенных клеток. В ходе сперматогенеза клеточные ассоциации находятся на различных стадиях развития, что обусловливает мозаичное распределение клеточных ассоциаций в составе сперматогенного эпителия.
Рис. 15-14. Клон сперматогенных клеток. На стадиях размножения, роста и созревания сперматогенные клетки связаны цитоплазматическими мостиками. Только на стадии формирования гамет цитоплазматические мостики разрываются, и сперматозоиды оказываются свободными. [17]
Созревание
За стадией роста наступает стадия созревания, которая состоит из следующих друг за другом двух делений мейоза. В результате первого деления из одного сперматоцита первого порядка образуется два сперматоцита второго порядка, а после второго деления — четыре сперматиды (см. рис. 15-8 и 15-12). Сперматиды располагаются вблизи просвета канальца. Каждая сперматида вчетверо мельче сперматоцита первого порядка и имеет ядро с гаплоидным набором хромосом.
Формирование
Спермиогенез — постмейотическая стадия морфологической дифференцировки сперматиды в сперматозоид. В составе комплекса Гольджи (на одном из полюсов ядра) появляется акросомный пузырёк с акросомной гранулой, одновременно центриоли мигрируют на противоположную сторону ядра и инициируют сборку аксонемы. Акросомная гранула заполняет акросомный пузырёк и образуется акросомная шапочка. Хроматин конденсируется, ядро вытягивается и приобретает окончательную форму. Цитоплазматические микротрубочки, растущие от центриолей, образуют цилиндрическую манжетку, способствующую элонгации сперматиды. Митохондрии располагаются спиралеобразно вокруг аксонемы. Сперматида переворачивается хвостом в просвет канальца. Между клетками разрываются цитоплазматические мостики, а сформировавшиеся сперматозоиды оказываются свободными.
Пластичность межклеточных контактов в сперматогенном эпителии. Выход сперматоцитов из базального пространства в адлюминальное и последующее отделение дифференцированных сперматозоидов от поддерживающих клеток обусловлены дезинтеграцией межклеточных контактов как между сустентоцитами, так между сустентоцитами и гаметами (см. рис. 15-13). Главную роль в дезинтеграции контактов играют протезы и цитокины, в т.ч. TGFb 3 и TNFa. Высокие концентрации тестостерона и Ca2+ способствуют восстановлению межклеточных контактов.
Мужское бесплодие
В эякуляте здорового мужчины содержится примерно от 150 до 600 млн сперматозоидов. В 23% случаев мужского бесплодия обнаруживается патозооспермия (отсутствие или недостаточное количество сперматозоидов, морфологические дефекты, снижение подвижности сперматозоидов).
· Неподвижные сперматозоиды. При синдромах Картагенера и неподвижных ресничек сперматозоиды не передвигаются, хотя такие мужчины потенциально фертильны. В этих случаях проводят оплодотворение in vitro с последующим введением концептуса в матку.
· Дефектная акросома. По разным оценкам, эта патология составляет до 15% мужского бесплодия. Сперматозоиды имеют головку округлой формы, они подвижны, но невозможна акросомная реакция.
· Азооспермия. В эякуляте нет сперматозоидов. Причины: дефекты сперматогенеза при мутациях гена одного из факторов азооспермии (фактор 1 азооспермии, ген AZF; фактор 2 азооспермии, ген AZF2; Y-сцепленное наследование), лучевое поражение, непроходимость выводящих путей мужской половой системы.
· Олигозооспермия. Число сперматозоидов в 1 мл эякулята 20 млн и менее.
Спермограмма включает характеристики сперматозоидов (количество, морфология, жизнеспособность, подвижность, агглютинация) и семенной жидкости (объём, рН, вязкость, лейкоциты, микрофлора).
Биохимическое исследование (цинк, лимонная кислота, фруктоза, кислая фосфатаза) спермы проводят для оценки функциональной активности предстательной железы и семенных пузырьков.
Гормональная регуляция сперматогенеза
Гипоталамо-гипофизарная система при помощи гонадолиберина активирует синтез и секрецию гонадотропных гормонов гипофиза, влияющих на активность поддерживающих эпителиальных и интерстициальных эндокринных клеток. В свою очередь вырабатываемые в яичке гормоны корректируют эндокринную деятельность гипоталамо-гипофизарной системы (рис. 15-15).
Гонадолиберин
Гонадолиберин поступает в кровь из аксонов нейросекреторных клеток в пульсирующем режиме с пиковыми интервалами около двух часов. Гонадотропные гормоны, как и гонадолиберин, высвобождаются в кровь также в пульсирующем режиме, что особенно характерно для лютропина, пики концентрации которого в крови мужчин наблюдаются с интервалами 90–120 мин.
Гонадотропные гормоны
Секреция гонадотропных гормонов поддерживается гонадолиберином, а угнетается тестикулярными гормонами. Тормозящий эффект тестостерона на секрецию лютропина в основном проявляется на уровне гипоталамуса (через синтез гонадолиберина), тогда как эстрогены снижают чувствительность гонадотропных клеток к гонадолиберину. Половые стероиды слабо влияют на секрецию фоллитропина, в то время как пептидный гормон ингибин оказывает выраженное подавляющее действие на синтез фоллитропина. Мишени гонадотропных гормонов — яички. Сустентоциты имеют рецепторы фоллитропина, а интерстициальные эндокринные клетки — лютропина.
Фоллитропин активирует в поддерживающих эпителиальных клетках синтез и секрецию ингибина и эстрогенов.
Лютропин стимулирует в интерстициальных эндокринных клетках синтез и секрецию тестостерона.
Пролактин. Механизмы участия пролактина в регуляции функций яичка не очень ясны, хотя секреция адекватного количества пролактина кажется необходимой для синтеза тестостерона. Увеличение уровня пролактина в крови ведёт к подавлению синтеза тестостерона. У больных с выраженной гиперпролактинемией в результате снижения секреции тестостерона развивается импотенция.
Рис. 15-15. Гормональная регуляция сперматогенеза. Секрецию гонадотропных гормонов регулирует гонадолиберин. Фоллитропин стимулирует в сустентоцитах секрецию андроген-связывающего белка (АСБ), а также ингибина, который блокирует секрецию фоллитропина гонадотрофами аденогипофиза по принципу отрицательной обратной связи. Лютропин активирует в интерстициальных эндокринных клетках секрецию тестостерона. Часть тестостерона поступает в кровоток, а другая часть в сустентоцитах соединяется с АСБ и секретируется в адлюминальное пространство, или путём ароматизации превращается в эстрогены. Циркулирующие в крови тестостерон и эстрадиол оказывают отрицательный обратный эффект на секрецию лютропина. [114]
Тестикулярные гормоны
Тестостерон поступает в сустентоциты, в цитозоле связывается с АСБ и далее секретируется в адлюминальное пространство, для поддержания сперматогенеза. Часть тестостерона конвертируется в эстрогены. Тестостерон и эстрогены крови оказывают ингибирующий эффект на секрецию лютропина гонадотрофами аденогипофиза.
Эстрадиол. В гладком эндоплазматическом ретикулуме сустентоцитов путём ароматизации происходит превращение тестостерона, синтезированного в интерстициальных эндокринных клетках, в эстрогены. Эстрогены связываются с рецепторами в интерстициальных эндокринных клетках и по паракринному механизму подавляют синтез тестостерона.
Ингибин. В ответ на стимуляцию фоллитропином клетки сустентоциты секретируют ингибин, блокирующий синтез фоллитропина гонадотропными клетками аденогипофиза. Структура ингибина гомологична MIF, секретируемому фетальными сустентоцитами.
Гипогонадизм
Тестикулярная недостаточность поражает две функции — сперматогенез в извитых семенных канальцах и синтез тестостерона в интерстициальных эндокринных клетках. Дефекты сперматогенеза вызывают стерильность; дефицит тестостерона приводит к неадекватному развитию и поддержанию вторичных половых признаков. Причины гипогонадизма: нарушения в гипоталамо-гипофизарной системе (гипогонадотропный гипогонадизм) и первичные нарушения яичек с неизбежной стимуляцией секреции лютропина и фоллитропина (гипергонадотропный гипогонадизм).
· До полового созревания тестикулярная недостаточность препятствует нормальному половому развитию. Пенис и яички остаются маленькими, сперматозоиды отсутствуют. Оволосение на лице и теле скудное. Голос сохраняется высоким; мышечная масса и сила снижены. Увеличение роста длинных костей (из-за замедленного закрытия эпифизарных хрящей) вызывает евнухоидный вид, при котором размах рук на 6 см и более превышает рост, а расстояние от пола до лонного сращения на 5-7 см больше расстояния от симфиза до макушки.
· После полового созревания тестикулярная недостаточность проявляется потерей либидо и потенции. Постепенно наступает частичная регрессия вторичных половых признаков, замедляется рост волос на лице и теле, снижается мышечная масса.
Придаток яичка
В придатке яичка различают головку (сaput epididymidis), тело (сorpus epididymidis) и хвост (сauda epididymidis). Головка придатка представлена 10–12 выносящими канальцами (ductuli efferentes). Тело и хвост придатка образованы протоком придатка (ductus epididymis), в который открываются ductuli efferentes.
Выносящие канальцы придатка
Выносящие канальцы придатка прободают белочную оболочку (tunica albuginea) и соединяют сеть яичка (rete testis) с протоком придатка яичка (см. рис. 15-10). Они выстланы эпителием, клетки которого имеют разную высоту (гирляндный эпителий). Высокие цилиндрические клетки снабжены ресничками, способствующими перемещению сперматозоидов по канальцам. Низкие кубические клетки имеют складчатую поверхность с микроворсинками. В апикальной части клеток присутствуют многочисленные пиноцитозные пузырьки и лизосомы. Функция этих клеток заключается в реабсорбции жидкости, образующейся в извитых канальцах яичка. Снаружи эпителиальной выстилки располагается собственный слой с циркулярно ориентированными ГМК, также способствующих продвижению сперматозоидов по выносящим канальцам.
Проток тела придатка
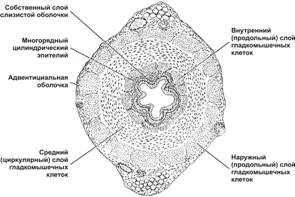
Проток тела придатка — одиночный и сильно извитой каналец длиной 4–6 м. Он выстлан многорядным цилиндрическим эпителием (рис. 15-16, 15-16А). В эпителии различают два типа клеток: базальные вставочные и высокие цилиндрические. Цилиндрические клетки снабжены стереоцилиями, склеенными в виде конуса (пламенный эпителий). Между основаниями цилиндрических клеток расположены мелкие вставочные клетки, являющиеся предшественниками цилиндрических клеток. Под эпителием располагается собственный слой, окружённый циркулярно ориентированными ГМК. Мышечный слой протока придатка по мере приближения к ductus deferens становится более выраженным и представлен тремя слоями: внутренним и наружным продольными и средним циркулярным. Сокращения ГМК способствуют продвижению сперматозоидов в семявыносящий проток.
Рис. 15-16. Проток придатка. Одиночный сильно извитой каналец, выстлан многорядным цилиндрическим эпителием, клетки которого снабжены стереоцилиями, склеенными в виде конуса (пламенный эпителий). Собственный слой, расположенный под эпителием, окружён циркулярно ориентированными гладкомышечными клетками. Окраска гематоксилином и эозином.
Рис. 15-16А. Пламенный эпителий ductus epididymis. [17]
Семявыносящий проток
Из придатка сперматозоиды попадают в семявыносящий проток (ductus deferens). Толстая стенка ductus deferens состоит из трёх оболочек: слизистой, мышечной и адвентициальной. Слизистая оболочка представлена собственным слоем слизистой и многорядным эпителием, который в проксимальной части семявыносящего протока по строению сходен с эпителием протока придатка. Мышечная оболочка образована тремя слоями ГМК: внутренним и наружным продольными и средним циркулярным. Мощная мышечная оболочка ductus deferens способствует выбрасыванию сперматозоидов во время эякуляции. Адвентициальная оболочка состоит из волокнистой соединительной ткани с кровеносными сосудами, нервами и группами ГМК (рис. 15-17). В составе семенного канатика ductus deferens проходит по паховому каналу в брюшную полость. Вблизи мочевого пузыря семявыносящий проток заканчивается ампулярным расширением. Сразу за ампулой после слияния с семенными пузырьками ductus deferens продолжается в семявыбрасывающий проток.
Рис. 15-17. Семявыносящий проток. Из придатка яичка сперматозоиды попадают в семявыносящий проток (ductus deferens). Стенка ductus deferens состоит из трёх оболочек. Слизистая оболочка представлена эпителием и собственным слоем. Мощная мышечная оболочка образована тремя слоями гладкомышечной ткани. Снаружи семявыносящий проток покрыт адвентициальной оболочкой. [17]
Ductus ejaculatorius проникает в предстательную железу и открывается в простатическую часть мочеиспускательного канала (в семенной холмик на гребне мочеиспускательного канала). Эпителий сходен с эпителием семявыносящего протока. Мышечная оболочка отсутствует. Эякуляцию обеспечивают ГМК хвоста придатка яичка и семявыносящего протока.
Добавочные железы
Семенные пузырьки, предстательную и бульбоуретральные железы принято называть добавочными железами мужской половой системы. Вклад секрета предстательной железы и семенных пузырьков в объём семенной жидкости составляет 95%, на сперматозоиды приходится лишь 5% общего объёма эякулята.
Семенные пузырьки
Семенные пузырьки — две сильно извитые трубки длиной до 15 см, открывающиеся в семявыбрасывающий проток (сразу за ампулой семявыносящего протока). Стенка трубки состоит из трёх оболочек: слизистой, мышечной и соединительнотканной.
Слизистая оболочка
Имеет выраженную складчатость и выстлана однослойным многорядным цилиндрическим эпителием (секреторные и базальные клетки).
· Секреторные клетки в апикальной части имеют микроворсинки и секреторные гранулы. Клетки содержат хорошо развитые гранулярную эндоплазматическую сеть и комплекс Гольджи, в цитоплазме присутствуют жировые включения и липохромный пигмент.
· Базальные клетки относятся к камбиальным элементам эпителия.
Мышечная оболочка
Она образована внутренним циркулярным и наружным продольным слоями ГМК. Сокращение ГМК при эякуляции способствует выбрасыванию секрета железы (семенной жидкости) в семявыбрасывающий проток.
Секрет
Семенные пузырьки секретируют вязкий желтоватого цвета (присутствие липохромного пигмента) секрет, поступающий в семявыбрасывающий проток во время эякуляции. Объём семенной жидкости составляет до 70% эякулята. Секрет семенных пузырьков разжижает семя, содержит фруктозу (основной субстрат сперматозоидов для синтеза АТФ), холин, белки, аминокислоты, соли аскорбиновой и лимонной кислот, простагландины — т.е. вещества, обеспечивающие сперматозоиды энергетическим запасом и повышающие их выживаемость и функциональную активность. В криминалистике обнаружение фруктозы (секретируется только в семенных пузырьках) и кристаллов холина указывает на следы спермы в исследуемом материале.
Предстательная железа
Развитие
Дифференцировка и рост предстательной железы находятся под контролем андрогенов. 5a-редуктаза в эпителиальных клетках простаты катализирует превращение тестостерона в дигидротестостерон, ответственный за пролиферацию и дифференцировку клеток железы. До пубертата рост простаты незначителен. В период полового созревания увеличивающийся уровень тестостерона стимулирует развитие и созревание предстательной железы.
Строение
Рис. 15-18. Предстательная железа окружает проксимальный отдел уретры. В паренхиме вокруг уретры находятся мелкие слизистые железы (периуретральная зона). Под капсулой расположены крупные главные железы (периферическая зона). Между слизистыми и главными находятся средние по размерам подслизистые железы (центральная зона). Выводной проток каждой железы открывается в просвет уретры. [17]
Рис. 15-18А. Предстательная железа. Секреторные отделы (1) и выводные протоки трубчато-альвеолярных желёз окружены гладкомышечными клетками (2). Каждая железа собственным выводным протоком открывается в уретру (3). Окраска гематоксилином и эозином.
Анатомически в железе различают 5 долей: правая и левая латеральные, правая и левая задние и средняя. Гистологически железа состоит из 30–50 разветвлённых трубчато-альвеолярных желёз (рис. 15-18, 15-18А), расположенных в трёх зонах. Периферическая (содержит самые крупные и большее количество железы), центральная и периуретральная. Железа снаружи покрыта соединительнотканной капсулой, содержащей ГМК. Соединительнотканные перегородки с хорошо развитой гладкой мускулатурой разделяют предстательную железу на дольки. Поскольку каждая отдельная железа простаты — разветвлённая трубчато-альвеолярная, то на срезе концевые отделы имеют самую различную форму: округлую, овальную, вытянутую, разветвлённую. Нередко у мужчин пожилого возраста в просвете секреторных отделов можно обнаружить конкременты — сферической формы тела диаметром до 250 мм, состоящие из белка и солей кальция. Каждая железа имеет собственный выводной проток, открывающийся в просвет уретры. Выводные протоки выстланы многорядным призматическим эпителием, который в дистальных отделах становится переходным.
Секреторные отделы выстланы однослойным кубическим или цилиндрическим эпителием (в зависимости от стадии секреции). В составе эпителия присутствуют базальные, железистые и эндокринные клетки.
Железистые клетки имеют выраженный белоксинтезирующий аппарат, в апикальной части клеток присутствуют мелкие светлые секреторные гранулы. Клетки продуцируют секрет, содержащий лимонную кислоту, простато-специфичную кислую фосфатазу, фибринолизин, простато-специфический антиген.
Эндокринные клетки редко разбросаны среди других эпителиальных клеток. В секреторных гранулах присутствуют соматостатин, серотонин, бомбезин.
Базальные клетки обеспечивают регенерацию железистого эпителия.
Секрет
Секрет предстательной железы попадает в мочеиспускательный канал за счёт сокращения ГМК, он принимает участие в разжижении семени и способствует его прохождению по мочеиспускательному каналу при эякуляции. Присутствующие в секрете предстательной железы протеолитические ферменты [фибринолизин, простато-специфический антиген (сериновая протеаза)] препятствуют склеиванию сперматозоидов.
Опухоли
Доброкачественная гиперплазия железы характеризуется ростом железистой ткани в периуретральной зоне латеральных и средней долей, что сопровождается обструкцией простатической части уретры. С возрастом увеличивается активность 5a-редуктазы и, как следствие, повышенное образование дегидротестостерона, стимулирующего рост предстательной железы. В лечении применяются ингибиторы 5a-редуктазы, блокирующие конвертирование тестостерона в дегидротестостерон, и антагонисты a-адренорецепторов, подавляющие секреторную активность железы.
Рак предстательной железы занимает 4 место среди онкологических заболеваний. Поскольку опухоль начинается в периферической зоне, то обструкция уретры возникает только на продвинутых стадиях заболевания. Мужчинам в возрасте старше 50 лет, имеющим проявления, предполагающие заболевание предстательной железы показано проведение ректальной пальпации предстательной железы и определение концентрации в сыворотке крови простато-специфического Аг.
Маркёры
· Кислая фосфатаза. Увеличение в крови содержания кислой фосфатазы может указывать на прорастание опухоли предстательной железы за пределы капсулы.
· Простато-специфический антиген (ген APS) — тест выявления рака предстательной железы, хотя уровень этого Аг может быть повышен и при гипертрофии (аденоме) предстательной железы.
Бульбоуретральные железы
Бульбоуретральные железы (glandula bulbourethralis) — две трубчато-альвеолярные железы небольшой величины, локализующиеся между скелетными мышцами мочеполовой диафрагмы и открывающиеся в губчатую часть уретры. Секреторный отдел железы выстлан эпителиальными клетками кубической и цилиндрической формы, которые продуцируют слизистый секрет, содержащий галактозу, галактозамин, галактуроновая и сиаловая кислоты. В соединительнотканной строме, разделяющей железу на многочисленные дольки, встречаются как ГМК, так и поперечнополосатые мышечные волокна. Предполагают, что вязкий слизистый секрет, выделяемый в период полового возбуждения, служит для смазки уретры перед эякуляцией.
Железы мочеиспускательного канала
Уретральные железы (glandulae urethrales) — слизистые трубчато-альвеолярные железы, расположены в слизистой оболочке губчатой части мочеиспускательного канала.
Половой член
Penis формируют три кавернозных тела. Парные, цилиндрической формы corpora cavernosa (пещеристые тела) располагаются на дорсальной стороне полового члена. На вентральной поверхности по средней линии находится corpus cavernosum urethrae (губчатое тело мочеиспускательного канала), имеющее расширенное основание (луковицу) и формирующее на дистальном конце головку полового члена. Кавернозные тела образованы анастомозирующей сетью перегородок (трабекул) из соединительной ткани и ГМК. В свободные пространства между покрытыми эндотелием перегородками открываются капилляры. Головку полового члена формирует плотная волокнистая соединительная ткань, содержащая сеть крупных извитых вен. Снаружи кавернозные тела окружены плотной соединительнотканной белочной оболочкой (tunica albuginea), состоящей из двух слоёв коллагеновых волокон — внутреннего циркулярного и наружного продольного. Белочная оболочка отсутствует на головке. Её покрывает тонкая кожа, в которой присутствуют сальные железы (gl. sebacea preputiales). Все три кавернозных тела объединены фасцией полового члена. Циркулярную складку кожи, покрывающей головку, называют крайней плотью.
Кровоснабжение
В расслабленном состоянии полового члена крупные артерии, проходящие в перегородках кавернозных тел, спирально закручены (aa. helicinae). Эти артерии имеют толстую мышечную оболочку. Продольные утолщения внутренней оболочки, состоящие из пучков ГМК и коллагеновых волокон, выбухают в просвет сосуда и служат клапанами, закрывающими просвет сосуда. Многие из этих артерий прямо открываются в межтрабекулярные пространства. В стенке вен полового члена кроме циркулярного слоя ГМК в средней оболочке, также присутствуют продольные слои ГМК во внутренней и наружной оболочках. Во время эрекции происходит расслабление ГМК перегородок и спиральных артерий. Артерии несколько распрямляются и кровь с меньшем сопротивлением поступает в свободные пространства кавернозных тел. Одновременное сокращение ГМК глубоких вен вызывает уменьшение просвета сосудов и препятствует оттоку крови из переполненных кровью межтрабекулярных пространств. Детумесценция (расслабление полового члена после эрекции) — следствие меньшего притока крови в результате сокращения ГМК перегородок и сужения спиральных артерий и облегчения оттока крови из кавернозных тел.
Иннервация
Кожа и сосудистое сплетение головки полового члена, фиброзные оболочки кавернозных тел, слизистая и мышечная оболочки перепончатой и простатической частей уретры считаются мощными рефлексогенными зонами, насыщенными разнообразными концевыми чувствительными приборами. Каждая из этих зон играет значительную роль при половом акте, являясь источником нервных импульсов, лежащих в основе безусловнорефлекторных реакций (эрекция, эякуляция, оргазм). Среди чувствительных приборов встречаются как свободные нервные окончания, так и инкапсулированные — пластинчатые тельца Пачини, тактильные тельца Майсснера, колбы Краузе, генитальные тельца.
Мужская уретра
Мочеиспускательный канал (трубка длиной около 12 см) проходит через простату (pars prostatica), прободает фасцию мочеполовой диафрагмы (pars membranacea), проникает в губчатое тело мочеиспускательного канала (pars spongiosa) и открывается наружным отверстием уретры на верхушке головки полового члена.
Простатическая часть
Просвет уретры (вследствие выпячивания на задней стенки гребня уретры) имеет V‑образную форму (рис. 15-18). Вдоль гребня остаются два синуса (sinus urethralis), в которые открываются протоки главных и подслизистых желёз простаты. По обе стороны с боков гребня в семенные холмики открываются семяизвергающие каналы. В области внутреннего отверстия мочеиспускательного канала ГМК наружного циркулярного слоя участвуют в образовании сфинктера мочевого пузыря. Простатическую часть уретры выстилает переходный эпителий, сходны с эпителием мочевого пузыря.
Перепончатая часть
Скелетная мускулатура мочеполовой диафрагмы формирует произвольный сфинктер уретры (наружный сфинктер мочевого пузыря). Переходный эпителий замещается высоким многослойным цилиндрическим. Слизистая и мышечная оболочки простатической и перепончатой частей уретры имеют мощную рецепторную иннервацию. Во время эякуляции происходят сильные периодические сокращения ГМК, вызывающие раздражения чувствительных окончаний, сопровождающие оргазм.
Губчатая часть
Проходя через луковицу губчатого тела, уретра расширяется, образуя луковицу мочеиспускательного канала. Расширение уретры в головке полового члена называют ладьевидной ямкой. После этого места эпителий становится многослойным плоским, который далее переходит в многослойный плоский ороговевающий, покрывающий головку полового члена. Устья бульбоуретральных желёз открываются в губчатую часть уретры сразу после её прохождения через мочеполовую диафрагму.
Основные понятия
Женская половая система складывается из парных яичников (ovarium) и маточных труб (tuba uterina), матки (uterus), влагалища (vagina), наружных половых органов (organa genitalia feminina externa), а также молочных желёз (mamma).
Функция
Репродукция (воспроизводство) — главнейшая функция женской половой системы. Разные органы системы специализированы для выполнения конкретных задач.
Яичник — герминативная (овогенез, овуляция) и эндокринная (синтез и секреция эстрогенов и прогестерона).
Маточная труба — транспортная (продвижение сперматозоидов, яйцеклетки), оплодотворение.
Матка — вынашивание плода.
Канал шейки матки и влагалище — родовые пути.
Молочная железа — вскармливание ребёнка.
Цикличность
Органы половой системы женщины детородного возраста вне беременности подвергаются циклическим изменениям. Комплекс таких изменений — овариально-менструальный цикл. В среднем цикл продолжается 28 дней.
Овариальный цикл — продолжение овогенеза (фазы роста и созревания), овуляция, формирование жёлтого тела. Овариальный цикл регулируют гипофизарные гонадотропины — фолликулостимулирующий и лютеинизирующий гормоны.
Менструальный цикл — характерные изменения слизистой оболочки матки, имеющие целью возможность имплантации и без наступления последней заканчивающиеся отторжением функционального слоя эндометрия (менструация). Все фазы менструального цикла контролируют гормоны яичника — эстрогены и прогестерон.
Другие органы системы (маточные трубы, влагалище, молочные железы) также подвергаются изменениям в рамках овариально-менструального цикла.
Женские половые гормоны
К женским половым гормонам относятся эстрогены и прогестины. Стероидогенез половых гормонов представлен на рисунке 15-19.
Эстрогены
Эстрогены синтезируются фолликулярными клетками, клетками жёлтого тела и плаценты.
· Эстрадиол (17b-эстрадиол, Е2) образуется из тестостерона путём его ароматизации, обладает выраженной эстрогенной активностью. Ароматаза, называемая также эстроген синтетаза, катализирует образование Е2 из тестостерона. Синтез фермента индуцирует фоллитропин.
· Эстрон (Е1) образуется путём ароматизации андростендиона, имеет небольшую эстрогенную активность, выделяется с мочой беременных, обнаружен в фолликулярной жидкости растущих фолликулов яичника, в плаценте. 17b-гидроксистероид дегидрогеназа катализирует образование 17b-эстрадиола из эстрона.
· Эстриол (Е3) образуется из эстрона и эстрадиола в печени, экскретируется с мочой беременных, в значительном количестве присутствует в плаценте.
Рис. 15-19. Биосинтез эстрогенов и прогестинов. Холестерин поступает в клетки внутренней теки путём опосредованного рецептором эндоцитоза. Лютропин в клетках теки стимулирует синтез андрогенов как и в эндокринных интерстициальных клетках яичка. Из клеток теки андрогены диффундируют в клетки гранулёзы, в которых фоллитропин активирует ароматазу, катализирующую образование эстрона и эстрадиола. Прогестерон синтезируется в лютеиновую стадию цикла, когда клетки гранулёзы приобретают рецепторы лютропина. В клетках гранулёзы отсутствует активность 17a-гидроксилазы и десмолазы, катализирующих превращение прогестерона в андрогены и поэтому лютропин стимулирует стероидогенез в клетках гранулёзы до образования прогестерона. [114]
Рецепторы эстрогенов. Эффекты эстрогенов реализуются через рецепторные белки ER (Estrogen Receptor — рецептор эстрогенов), относящиеся к надсемейству ядерных стероидных-тиреоидных рецепторов и имеющие выраженную гомологию с протоонкогеном v-erbA. Рецепторные белки ERa и ERb (продукты экспрессии генов 6-й и 14-й хромосом соответственно) содержат 6 идентичных функциональных доменов, ответственных за связывание лиганда со специфическим промотором ДНК и активацию транскрипции гена-мишени. Эстрогены, взаимодействуя с ER, вызывают диссоциацию рецепторов с молекулами-шаперонами Hsp70 и Hsp90 (Hsp — Heat shock protein — белок теплового шока). Освободившись от молекул-шаперонов, активированные ERa и ERb образуют эстрогеновые комплексы — гомодимеры (ERa–ERa, ERb–ERb) или гетеродимеры (ERa–ERb). Комплексы лиганд-рецептор транслоцируются в ядро клетки и прямо взаимодействуют с эстроген-чувствительным элементом в промоторе гена-мишени, активируя его транскрипцию. Активированные рецепторы эстрогенов — факторы транскрипции широкого спектра генов-регуляторов многочисленных функций половой сферы: лютеинизирующего гормона, пролактина, окситоцина, рецептора прогестерона, а также генов, участвующих в процессах пролиферации, дифференцировки, роста и апоптоза — c-jun, c-fos, bcl-2, сосудистого эндотелиального фактора роста (VEGF).
Мембранные рецепторы эстрогенов. Активация этих рецепторов запускает альтернативный механизм действия эстрогенов, подразумевающий эстроген-индуцированную активацию системы вторых посредников. Эстрогеновые комплексы (лиганд-рецептор) взаимодействуют с многими сигнальными внутриклеточными каскадами, например нейротрофинов, инсулиноподобного фактора роста, циклического аденозинмонофосфата (цАМФ), NMDA (N–methyl-D–aspartate — N–метил-D–аспартат) рецепторов, PI 3-киназы (Phosphatidyl Inositol 3-Kinase — фосфатидил инозитол 3-киназа), семейства MAPK (Mitogen-Activated Protein Kinases — митоген-активируемые протеин киназы), включая ERK (Extracellular Signal-Regulated Kinase — киназа, регулируемая внеклеточным сигналом) и p38-киназы. По альтернативному механизму действия эстрогены путем активации системы вторых посредников либо модулируют активность специфических генов (непрямой геномный механизм), либо вызывают немедленный функциональный ответ клетки (негеномный механизм). Через непрямой геномный механизм эстрогены модулируют транскрипцию генов, в промоторе которых отсутствует эстроген-чувствительный элемент. Альтернативный негеномный механизм действия эстрогенов проявляется, в частности, в регуляции гомеостаза внутриклеточного Са2+, при инактивации высокореактивных свободных радикалов, например радикала супероксида, гидроксильного радикала.
Прогестины
К прогестинам относится прогестерон, синтезируемый клетками жёлтого тела яичника в лютеиновую стадию овариально-менструального цикла, а также клетками хориона при наступлении беременности. Стимулируют синтез прогестерона лютропин и ХГТ. Рецептор прогестерона (ген PGR) относится к ядерным. Дефект рецептора прогестерона приводит к отсутствию характерных для секреторной фазы менструального цикла изменений эндометрия.
Поверхность яичника покрыта одним слоем кубических эпителиальных клеток (mesovarium), находящихся на толстой соединительнотканной пластинке — белочной оболочке яичника (t. albuginea). Паренхима яичника (рис. 15-20, 15-20А) состоит из коркового и мозгового вещества. Мозговое вещество органа образовано рыхлой соединительной тканью, богатой эластическими волокнами, кровеносными, лимфатическими и нервными сплетениями. От артерий и вен, имеющих извилистый ход, к корковому веществу отходят короткие радиальные сосуды. Корковое вещество содержит: примордиальные фолликулы, растущие фолликулы (первичные, вторичные и третичные), зрелые фолликулы, жёлтые тела (corpus luteum), белые тела (corpus albicans), атретические фолликулы (folliculus atreticus).
Рис. 15-20. Яичник. В корковом веществе видны примордиальные фолликулы (1), первичный фолликул (2), жёлтое тело (3), атретический фолликул (4). Окраска гематоксилином и эозином.
Рис. 15-20А. Яичник. В корковом веществе яичника располагаются фолликулы и их производные различной степени зрелости. Мозговое вещество представлено рыхлой соединительной тканью, содержащей сосудистые и нервные сплетения. [17]
Рак яичников, составляющий главную причину смертности в группе гинекологических опухолей, выявляют у одной из 70 женщин. Определение опухолевого маркёра СА 125 рекомендовано лицам, имеющим семейные случаи этого заболевания. Наиболее часто возникает кистозная опухоль, происходящая из поверхностного эпителия, содержит серозную жидкость или слизь. Дисгерминомы (эквивалент семиномы яичка) образуются из зародышевых клеток. Из стволовых клеток мезенхимы коркового вещества яичников происходят тека-клеточные, гранулёза-клеточные и гранулёза-тека-клеточные опухоли.
Овариальный цикл
Первая половина овариального цикла — фолликулярная (под влиянием ФСГ происходит развитие части примордиальных фолликулов), вторая половина — лютеиновая (под влиянием ЛГ из клеток овулировавшего фолликула формируется эндокринная железа — жёлтое тело). Овуляция приходится примерно на середину цикла. Развитие фолликулов происходит по схеме: примордиальный ® первичный ® вторичный ® третичный ® зрелый (преовуляторный). Овариальный цикл сопровождается характерными изменениями содержания гормонов в крови (рис. 15-21).
Развитие фолликула
Примордиальные фолликулы
Примордиальные фолликулы (folliculus ovaricus primordialis) располагаются непосредственно под белочной оболочкой яичника в виде компактных групп. Каждый примордиальный фолликул состоит из крупной округлой клетки — овоцита первого порядка, покрытого одним слоем плоских фолликулярных клеток (гранулёза, клетки гранулёзы) и окружён базальной мембраной. Многочисленные отростки фолликулярных клеток достигают плазмолеммы овоцита и образуют с ним щелевые и адгезионные контакты. При рождении девочки в яичниках содержится около двух миллионов примордиальных фолликулов. С наступлением половой зрелости таких фолликулов остаётся не более 400 тысяч. 98% примордиальных фолликулов в течение репродуктивного периода погибает, около 2% достигает стадии первичного и вторичного фолликулов, не более 400 развивается в преовуляторный фолликул и подвергается овуляции (каждый цикл — 1, много реже — 2).
· Риск генных дефектов плода увеличивается с возрастом матери, что не в последнюю очередь объясняется чрезвычайно большой продолжительностью жизни овоцита до его оплодотворения (до 40–50 лет). Частота рождения детей с синдромом Дауна увеличивается с возрастом матери от 1:2000 в 20 лет до 1:12 в 50 лет.
· Каждый овариальный цикл от 3 до 30 примордиальных фолликулов под влиянием ФСГ вступает в фазу роста и формирует первичные фолликулы. Все начавшие развитие, но не достигшие стадии овуляции фолликулы подвергаются атрезии. Атретические фолликулы содержат погибший овоцит, полость отсутствует, характерна сморщенная прозрачная оболочка, окружённая дегенерирующими фолликулярными клетками, между которыми находятся волокнистые структуры.
· Без стимуляции фоллитропином некоторые примордиальные фолликулы развиваются до стадии вторичного фолликула. Это происходит при ановуляторном цикле (до периода полового созревания, при беременности, при использовании пероральных контрацептивов), так и во время овуляторного цикла.
Первичные фолликулы
В первичных фолликулах (folliculus ovaricus primarius) фолликулярные клетки из плоских превращаются в кубические. Овоцит увеличивается в размерах.
Вторичные фолликулы
Фолликулярные клетки вторичных фолликулов (folliculus ovaricus secundarius) начинают активно делиться, в результате чего вокруг овоцита первого порядка образуется несколько слоёв кубических клеток. Между овоцитом и окружающими его фолликулярными клетками появляется толстая прозрачная оболочка (zona pellucida). Растущий фолликул приобретает наружную оболочку из элементов стромы яичника — theca. В составе этой оболочки различают внутренний клеточный слой (theca interna), содержащий синтезирующие андрогены интерстициальные клетки и богатую капиллярную сеть, и наружный фиброзный слой (theca externa), образованный соединительной тканью. Theca interna часто именуют просто тека. Интерстициальные клетки — клетки паренхимы яичника, вероятно, имеют одинаковый генез с клетками theca interna. Они также синтезируют и секретируют андрогены. Рост фолликула стимулируют ФСГ, эстрогены, норадреналин, инсулиноподобный фактор роста IGF-I.
· ФСГ в клетках гранулёзы индуцирует синтез ароматазы, которая катализирует превращение эстрогенов из андрогенов.
Недостаточность плацентарной ароматазы. Ароматизация фетальных андрогенов из коры надпочечников плода в плаценте беременной играет существенную роль в синтезе эстрогенов. Недостаточность плацентарной ароматазы приводит к снижению в крови беременной уровня эстрогенов и повышению уровня андрогенов, что сопровождается маскулинизацией беременной женщины.
· Эстрогены (преимущественно 17b-эстрадиол) стимулируют пролиферацию фолликулярных клеток (количество клеток гранулёзы стремительно увеличивается, фолликул растёт) и экспрессию новых рецепторов ФСГ и стероидов. Эстрогены усиливают действие фоллитропина на фолликулярные клетки, предотвращают атрезию фолликула.
· Норадреналин, действует на клетки гранулёзы через b2‑адренорецепторы, стимулирует в них стероидогенез, облегчает действие гонадотропных гормонов на продукцию стероидов и тем самым ускоряет развитие фолликула.
· Инсулиноподобный фактор роста IGF-I через рецепторную тирозин киназу стимулирует пролиферацию клеток гранулёзы, усиливает в них синтез прогестерона и ингибина.
Рис. 15-21. Дифференцировка фолликула. А — стадии развития: 1 — плоские фолликулярные клетки примордиального фолликула становятся кубическими, а фолликул дифференцируется в первичный; овоцит покрыт одним слоем фолликулярных клеток. 2 — вторичный фолликул; под влиянием фоллитропина увеличивается количество фолликулярных клеток, вокруг фолликула формируется оболочка (theca); 3 — третичный фолликул; между фолликулярными клетками образуются полости, заполненные фолликулярной жидкостью; 4 — зрелый фолликул (преовуляторный); сливаются отдельные пространства между фолликулярными клетками и образуется единая полость, заполненная фолликулярной жидкостью; яйцеклетка оттесняется к стенке фолликула. Б — связь фолликулярных клеток и яйцеклетки. Базальная мембрана отделяет фолликулярные клетки от окружающих тканей. Между фолликулярными клетками и яйцеклеткой находится прозрачная оболочка. Фолликулярные клетки при помощи цитоплазматических отростков проникают через прозрачную оболочку и достигают плазматической мембраны яйцеклетки. [17]
Третичные фолликулы
Третичные фолликулы (folliculus ovaricus tertiarius) характеризуются дальнейшим ростом. Между фолликулярными клетками появляются округлые полости, заполненные жидкостью (liquor folliculi). Появляется доминантный фолликул, опережающий в росте остальные, а в его составе формируется выраженная theca.
· Фолликулярные клетки усиливают продукцию эстрогенов. Эстрогены по аутокринному механизму увеличивают плотность рецепторов фоллитропина в мембране фолликулярных клеток.
· Фоллитропин стимулирует появление в мембране фолликулярных клеток рецепторов лютропина.
· Высокое содержание эстрогенов в крови блокирует секрецию фоллитропина, что тормозит развитие других первичных фолликулов и стимулирует секрецию ЛГ.
· Уровень лютропина поднимается в конце фолликулярной стадии цикла. Лютеинизирующий гормон стимулирует синтез андрогенов в клетках theca.
· Андрогены из theca через базальную мембрану (стекловидная оболочка на более поздних стадиях развития) диффундируют вглубь фолликула в клетки гранулёзы, где при помощи ароматазы конвертируются в эстрогены.
Зрелый фолликул
Зрелый фолликул (folliculus ovaricus matures) достигает 1–2,5 см в диаметре, прежде всего за счёт накопления жидкости в его полости. В полость пузырька вдаётся холмик из фолликулярных клеток (cumulus oophorus), внутри которого находится яйцеклетка. Яйцеклетка (на стадии овоцита первого порядка) окружена прозрачной оболочкой, снаружи от которой располагаются фолликулярные клетки (corona radiata). Стенка зрелого фолликула состоит из прозрачной оболочки, зернистой оболочки, теки.
Уровень эстрогенов быстро увеличивается, достигая пика приблизительно за 24–36 часов до овуляции.
Содержание ЛГ увеличивается постепенно до середины цикла. Резкий подъём его уровня происходит через 12 часов после наступления пика эстрогенов. Лютропин вызывает лютеинизацию клеток гранулёзы и theca interna (накопление жёлтого пигмента, липидов) и индуцирует преовуляторный синтез прогестерона.
Преовуляторное повышение уровня прогестерона облегчает положительное обратное действие эстрогенов (через синтез и секрецию лютропина), а также индуцирует преовуляторный пик фоллитропина за счёт усиления гипофизарного ответа на гонадолиберин.
Рис. 15-21А. Овулировавший овоцит. Диаметр овоцита приблизительно 150 мкм, в центре хорошо заметно крупное ядро. Расположенные вокруг овоцита вакуолизированные, нагруженные липидами клетки гранулёзы образуют лучистый венец.
Овуляция (рис. 15-21А) происходит примерно через 24–36 часов после пика эстрогенов и через 10–12 часов после достижения пика ЛГ, чаще всего на 11‑й, 12‑й или 13‑й дни 28‑дневного цикла. Однако, следует помнить, что при 28‑дневном цикле овуляция возможна между 8‑м и 20‑м днями. Истончение и разрыв стенки фолликула происходят под влиянием простагландинов и протеолитических ферментов гранулёзы.
Первое мейотическое деление овоцита завершается в зрелом фолликуле перед овуляцией на пике ЛГ. Лютропин стимулирует деление овоцита первого порядка с образованием овоцита второго порядка и первого полярного тельца.
Второе деление мейоза завершается не ранее оплодотворения.
· Фолликулярная киста — функциональная киста яичника —развивается из неовулировавшего зрелого фолликула, или после овуляции, если стенки фолликула в месте разрыва немедленно сомкнулись. Полость кисты выстилают гранулёза-лютеиновые гормон-продуцирующие клетки. Киста имеет диаметр более 2 см, обнаруживается пальпацией, или с помощью ультразвукового исследования, обычно разрешается спонтанно.
· Синдром поликистоза яичников характеризуется хроническим отсутствием овуляции, связанным с избытком андрогенов и лютропина и дефицитом фоллитропина. Синдром находят у 3-7% женщин репродуктивного возраста. Яичник вырабатывает избыточное количество андрогенных стероидов (преимущественно андростендион). Повышенное содержание андростендиона и других андрогенов препятствуют созреванию фолликулов, следствием чего является ановуляция, олигоаменорея, гирсутизм, ожирение.
Жёлтое тело
В лютеиновую стадию овариально-менструального цикла под действием ЛГ на месте лопнувшего зрелого фолликула образуется менструальное жёлтое тело. Жёлтое тело развивается из элементов преовуляторного фолликула и состоит из лютеинезированных фолликулярных клеток (гранулёза-лютеиновые) и клеток theca interna (тека-лютеиновые), между которыми расположены капилляры синусоидного типа (рис. 15-22). В процессе лютеинизации клетки гипертрофируются, в них увеличивается содержание элементов гладкой эндоплазматической сети, накапливаются жировые включения. Васкуляризация жёлтого тела увеличивает поступление холестерина в клетки гранулёзы и влияние лютропина на стероидогенез. Лютропин стимулирует в клетках гранулёзы синтез прогестерона. В клетках гранулёзы отсутствует активность десмолазы и 17a-гидроксилазы, поэтому прогестерон не вступает в дальнейшие превращения, а секретируется в кровь. Менструальное жёлтое тело функционирует в лютеиновую стадию цикла, поддерживая в крови высокий уровень эстрогенов и прогестерона, обеспечивающих подготовку эндометрия к имплантации. Дальнейшее развитие жёлтого тела стимулирует ХГТ, вырабатываемый в трофобласте. Если оплодотворения не произошло, жёлтое тело подвергается инволюции, а в крови резко снижается содержание прогестерона и эстрогенов.
Рис. 15-22. Жёлтое тело состоит из гранулёза-лютеиновых (в центре) и окружающих их тека-лютеиновых клеток. [17]
Менструальное жёлтое тело функционирует до завершения цикла (имплантации нет). Уровень прогестерона достигает пика через 8–9 дней после овуляции, что приблизительно соответствует времени имплантации.
Жёлтое тело беременности. ХГТ, секретируемый клетками трофобласта, через рецепторы ЛГ лютеиновых клеток стимулирует рост жёлтого тела, достигающего в диаметре 5 см, и увеличивает продукцию половых гормонов. Высокий уровень прогестерона и эстрогенов сохраняет развивающуюся беременность. Релаксин — гормон из семейства инсулинов, синтезируется клетками жёлтого тела и цитотрофобластом — в течение беременности оказывает расслабляющий эффект на миометрий и уменьшает плотность лонного сочленения. Жёлтое тело беременности активно в течение первой половины беременности, затем его функция постепенно угасает.
Белое тело — соединительнотканный рубец на месте дегенерировавшего жёлтого тела.
Гормональная регуляция овариального цикла
Овариально-менструальный цикл (рис. 15-23) контролируют гипофизарные гонадотропины — ФСГ и ЛГ. Эндокринную функцию передней доли гипофиза регулирует гипоталамический люлиберин. В свою очередь гормоны яичника (эстрогены, прогестерон, а также ингибин) вовлечены в регуляцию синтеза и секреции гонадотропинов гипофиза и люлиберина. Таким образом, циклические изменения яичника и эндометрия — иерархическая (гипоталамус ® гипофиз ® яичники ® матка) и саморегулируемая (яичники ® гипоталамус и гипофиз) система, функционирующая в течение репродуктивного периода (от менархе до наступления климактерических изменений — менопаузы).
Рис. 15-23. Овариально-менструальный цикл. Циклические изменения содержания в крови гонадотропных гормонов регулируют созревание очередного фолликула и овуляцию (А и Б). По мере развития фолликула в крови повышается уровень эстрогенов, а с момента овуляции и образования жёлтого тела увеличивается концентрация прогестерона (Б и В). Эстрогены и прогестерон вызывают характерные изменения в эндометрии матки в зависимости от стадии цикла (В и Г). [17]
Гонадолиберин
Гонадолиберин (люлиберин) синтезируют нейроэндокринные клетки предзрительного поля и гипоталамической области. Секреция гонадолиберина имеет пульсирующий характер: пики усиленной секреции гормона продолжительностью несколько минут сменяются 1–3‑часовыми интервалами относительно низкой секреторной активности. При этом период полужизни гонадолиберина в крови занимает 2–4 мин, что способствует циклическому воздействию гонадолиберина на клетки-мишени. Из гипоталамуса по портальной системе кровотока люлиберин поступает а аденогипофиз, где стимулирует секрецию гонадотрофных клеток (рис. 15-24). Частоту и амплитуду секреции гонадолиберина регулирует уровень эстрогенов и прогестерона. В фолликулярную стадию цикла гонадолиберин стимулирует секрецию гормонов гонадотрофными клетками. В лютеиновую стадию цикла режим секреции гонадолиберина недостаточен для стимуляции секреции гонадотропных гормонов, а следовательно, для роста и созревания очередного фолликула.
Синдром Кальманна характеризуется недостаточной секрецией гонадотропинов и проявляется гипогонадизмом в сочетании с аносмией (потеря обоняния). Нейроэндокринные клетки, секретирующие люлиберин, как и обонятельные нейроны, происходят из нейрогенных плакод. Синдром Кальманна развивается вследствие нарушения миграции клеток обонятельных плакод. Введение экзогенного гонадолиберина через интервалы 90–150 мин восстанавливает функцию половых желёз у больных с синдромом Кальманна.
Рис. 15-24. Секреция гонадотропных гормонов. Люлиберин стимулирует секрецию гормонов гонадотрофными клетками, взаимодействуя с рецептором, связанным с G–белком. Люлиберин активирует несколько внутриклеточных каскадов, в т.ч. протеин киназы С (РКС) и фосфолипазы С (PLC). PLC катализирует образование инозитолтрифосфата и диацилглицерола. Инозитолтрифосфат увеличивает в цитозоле содержание Са2+, который стимулирует секрецию, а диацилглицерол активирует РКС, стимулирующую транскрипцию гонадотропных гормонов. Лютропин и фоллитропин — димеры, состоящие из общей a- и специфической b–СЕ. Ритмическая секреция люлиберина отражается на ритмической экспрессии генов, кодирующих a–СЕ, b–СЕ фоллитропина и b–СЕ лютропина. Дифференциальная экспрессия b–СЕ фоллитропина или лютропина зависит от эстрогенов, ингибина и активина. [114]
Фолликулярная стадия цикла
Резкое падение содержания эстрогенов и прогестерона в конце каждого цикла (вследствие инволюции менструального жёлтого тела) стимулирует нейросекреторные клетки гипоталамуса к выделению гонадолиберина с пиками усиленной секреции гормона продолжительностью несколько минут с интервалом в 1 час. В первую очередь гормон секретируется из пула, запасённого в гранулах, а затем — тотчас по окончании синтеза. Такой режим секреции гонадолиберина активирует гонадотрофные клетки аденогипофиза.
Лютеиновая стадия цикла
Жёлтое тело активно продуцирует половые гормоны. На фоне высокого содержания эстрогенов и прогестерона интервал между пиками усиленной секреции гонадолиберина увеличивается до 2–3 часов, что недостаточно для стимуляции секреции гонадотропных гормонов.
Фоллитропин
Секреция. В фолликулярную стадию (в начале цикла) на фоне пониженного содержания в крови эстрогенов и прогестерона гонадолиберин стимулирует секрецию фоллитропина. Эстрогены (с пиком за сутки до овуляции) и ингибин подавляют продукцию ФСГ в лютеиновую фазу цикла.
Мишени фоллитропина — фолликулярные клетки. ФСГ (действуя вместе с эстрадиолом) увеличивает плотность рецепторов фоллитропина в мембране клеток гранулёзы, тем самым усиливая своё действие на мишень.
Функция. ФСГ стимулирует пролиферацию фолликулярных клеток и рост фолликула. Активирует в клетках ароматазу и усиливает секрецию эстрогенов. Инициирует встраивание рецепторов ЛГ в мембране фолликулярных клеток и секрецию ингибина в конце фолликулярной стадии.
Лютропин
Секреция. В конце фолликулярной стадии на фоне высокой концентрации эстрогенов блокируется продукция фоллитропина и одновременно стимулируется секреция лютропина. Пик лютропина наблюдается за 12 часов до овуляции. Сигналом для снижения уровня ЛГ является начало секреции клетками гранулёзы прогестерона. На пике ЛГ завершается первое деление мейоза.
Мишени. Рецепторы ЛГ имеют клетки theca фолликулов и клетки гранулёзы. После активации фоллитропином в клетках появляются рецепторы лютропина.
Функция. Лютеинизация фолликулярных клеток и клеток внутренней теки. Стимуляция синтеза андрогенов в клетках theca. Индукция секреции прогестерона клетками гранулёзы. Активация протеолитических ферментов гранулёзы.
Эстрогены и прогестерон
Секреция эстрогенов клетками гранулёзы постепенно нарастает в фолликулярную стадию и достигает пика за сутки до овуляции. Продукция прогестерона начинается в клетках гранулёзы до овуляции; основной источник прогестерона — жёлтое тело. В лютеиновую стадию овариального цикла лютеиновые клетки жёлтого тела значительно усиливают синтез эстрогенов и прогестерона.
Мишени. К половым гормонам чувствительны нейросекреторные клетки гипоталамуса, гонадотрофные клетки, фолликулярные клетки яичника, клетки слизистых оболочек матки, яйцевода, влагалища, альвеолярные клетки молочных желёз.
Функции. Уровень эстрогенов и прогестерона определяет избирательную активность нейроэндокринных клеток гипоталамуса и гонадотрофов. Одновременное повышение содержания в крови прогестерона и эстрогенов увеличивает интервал между фазами усиленной секреции гонадолиберина до 2–3 часов, что блокирует продукцию гонадотропных гормонов, а следовательно, рост и созревание очередного фолликула. При резком снижении содержания в крови половых гормонов пики секреции гонадолиберина разделены одночасовым интервалом. На этом фоне в аденогипофизе активируется секреция фоллитропина (начинается фолликулярная стадия нового цикла).
Пероральные контрацептивы. Ключевая позиция — ингибирование секреции гонадолиберина к середине цикла, что предупреждает увеличение содержания гипофизарных гонадотропинов и тем самым предупреждает овуляцию. Существует две категории препаратов: содержащие синтетические эстрогены и прогестерон либо только прогестерон. Пероральные контрацептивы снижают риск возникновения рака яичника и матки, доброкачественных заболеваний молочной железы.
Ингибины и активины
Ингибины и активины — гормоны белковой природы, модулирующие активность гонадотрофов. В образовании гормонов участвуют гликозилированная a–СЕ и две негликозилированных b–СЕ (bА и bВ). Ингибины образованы a–СЕ и одной из b–СЕ, тогда как активины состоят только из двух b–СЕ в различных сочетаниях. Ингибины и активины секретируют клетки гранулёзы. В ответ на стимуляцию фоллитропином, а также эстрогенами и лютропином за несколько часов до овуляции ингибин по принципу отрицательной обратной связи подавляет продукцию гонадотрофными клетками фоллитропина. Активин, напротив, поддерживает секрецию фоллитропина в фолликулярную стадию цикла.
Маточные трубы
Яйцевод — трубчатый орган длиной 10–12 см и диаметром 0,5–1 см, ответственный за оплодотворение и обеспечивающий перемещение концептуса в матку. Анатомически яйцевод делят на воронку (infundibulum), от которой отходят многочисленные отростки (фимбрии); ампулу — самый длинный и с наибольшим диаметром просвета отдел, где происходит оплодотворение; перешеек (isthmus) — примыкающий к матке короткий отдел и интрамуральный отдел (pars uterina).
Строение
В стенке маточной трубы (рис. 15-25, 15-25А) различают три оболочки: слизистую, мышечную и серозную (отсутствует во внутриматочной части трубы).
Слизистая оболочка окружает просвет яйцевода, образуя огромное количество ветвящихся складок. Собственный слой слизистой оболочки построен из рыхлой волокнистой неоформленной соединительной ткани, богатой кровеносными сосудами. Эпителий слизистой оболочки состоит из одного слоя цилиндрических клеток, среди которых различают реснитчатые и секреторные клетки.
· Секреторные клетки имеют выраженную гранулярную эндоплазматическую сеть и комплекс Гольджи. В апикальной части клеток содержится большое количество секреторных гранул. Клетки более активны в секреторную фазу менструального цикла. Они продуцируют жидкость, содержащую питательные вещества для сперматозоидов и развития концептуса.
· Реснитчатые клетки несут на апикальной поверхности реснички, совершающие движения по направлению к матке. Сила и амплитуда биения ресничек зависит от эстрогенов и прогестерона.
Мышечная оболочка состоит из двух слоёв ГМК (внутреннего циркулярного и наружного продольного). Слои отделены друг от друга прослойкой соединительной ткани со значительным количеством кровеносных сосудов.
Серозная оболочка имеет стандартное строение.
Рис. 15-25. Маточная труба. Слизистая оболочка образует высокие ветвящиеся складки, состоит из однослойного цилиндрического эпителия и собственного слоя слизистой. Мышечная оболочка образована циркулярным и продольным слоями ГМК. Снаружи яйцевод покрывает серозная оболочка. [17]
Рис. 15-25А. Маточная труба. В просвет трубы вдаются ветвящиеся складки слизистой оболочки. Однослойный цилиндрический эпителий (1) состоит из реснитчатых и секреторных клеток. Собственный слой слизистой оболочки (2), образующий основу складок, представлен рыхлой волокнистой соединительной тканью. Мышечная оболочка (3) образована циркулярным и продольным слоями гладкомышечных клеток. Окраска гематоксилином и эозином.
Перемещение яйцеклетки
Перед овуляцией увеличение тонуса ГМК маточной трубы приближает воронку маточной трубы к поверхности яичника. Биение ресничек эпителиальных клеток фимбрий ампулы маточной трубы создаёт ток жидкости, способствующий перемещению яйцеклетки из брюшной полости в ампулу. При синдроме Картагенера и синдроме неподвижных ресничек женщины фертильны.
Трубная беременность. Имплантация бластоцисты произошла в маточной трубе, чаще в ампуле. На фоне задержки менструации (60 дней от последней менструации) внезапно возникают резкие боли внизу живота, в крови обнаруживается ХГЧ.
Матка
Матка — полый мышечный орган, предназначенный для развития плода. В матке различают тело, дно и шейку. Тело матки занимает центральное положение и имеет треугольную форму. Дно матки располагается над устьем маточных труб. Книзу тело матки продолжается в канал шейки матки, открывающийся во влагалище. Стенка матки образована тремя оболочками: слизистой, мышечной и серозной (рис. 15-26).
Слизистая оболочка матки (endometrium) выстлана однослойным цилиндрическим эпителием, лежащим на рыхлой волокнистой неоформленной соединительной ткани собственного слоя. Среди эпителиальных клеток различают секреторные и реснитчатые клетки. В собственном слое имеются маточные железы (крипты): длинные изогнутые простые трубчатые железы, открывающиеся в просвет матки (рис. 15-26А).
Рис. 15-26. Матка. Слизистая оболочка состоит из однослойного цилиндрического эпителия и собственного слоя. В собственном слое слизистой оболочки присутствуют простые трубчатые железы. Мышечная оболочка представлена внутренним и наружным продольными слоями ГМК и средним — циркулярным. Снаружи орган окружает серозная оболочка. [17]
Рис. 15-26А. Матка. Слизистая оболочка находится в пролиферативной фазе менструального цикла. В собственном слое (1) видны маточные железы (3), открывающиеся в просвет органа (4). Мышечная оболочка (3) состоит из внутреннего и наружного продольных и среднего циркулярного слоёв гладкомышечных клеток. Окраска гематоксилином и эозином.
Эндометриоз — гормонозависимый патологический процесс, характеризующийся образованием эктопических очагов функционирующей ткани эндометрия. Возникает в результате ретроградного поступления менструальной крови и проникновения клеток эндометрия в полость таза или распространения фрагментов эндометрия по кровеносным или лимфатическим сосудам (экстрагенитальный эндометриоз).
Мышечная оболочка матки (myometrium) состоит из трёх слоёв гладкой мускулатуры. Направление удлинённых ГМК в слоях мышечной оболочки различное: продольное в наружном и внутреннем, циркулярное — в среднем. В среднем слое находится множество кровеносных сосудов (stratum vasculare). Величина ГМК, их количество, толщина мышечной оболочки резко увеличиваются при беременности. При родах окситоцин и простагландины (PGE2 и PGF2a) стимулируют сокращение ГМК, облегчая изгнание плода.
Фибромиома матки — гормонально-зависимая доброкачественная опухоль, состоящая из гладкомышечных и соединительнотканных элементов. Выявляют у 4–11% всех женщин, у 20% женщин старше 30 лет и у 40% женщин старше 50 лет.
Серозная оболочка матки (perimetrium) имеет обычное строение.
Шейка матки
Это нижний сегмент матки (2,5−3 см), частично выступающий во влагалище (рис. 15-27). Надвлагалищная часть шейки матки, располагающаяся выше места прикрепления стенок влагалища, открывается в полость матки внутренним маточным зевом. Влагалищная порция шейки матки (экзоцервикс) заканчивается наружным маточным зевом. Снаружи влагалищная порция покрыта многослойным плоским эпителием, который полностью обновляется каждые 4–5 дней путем десквамации поверхностных и пролиферации базальных клеток. Шейка матки имеет узкий и несколько расширенный в средней части канал (эндоцервикс). Стенка шейки образована плотной соединительной тканью. Среди коллагеновых и эластических волокон встречаются продольные пучки ГМК. В родах под действием релаксина плотная соединительная ткань становится мягкой и податливой. Слизистая оболочка канала шейки матки состоит из однослойного цилиндрического эпителия и собственного слоя. В эпителии различают железистые клетки, продуцирующие слизь, и клетки, имеющие реснички. В просвет канала открываются многочисленные разветвлённые трубчатые железы, располагающиеся в собственном слое слизистой оболочки. Вблизи наружного зева однослойный цилиндрический эпителий слизистой оболочки канала шейки матки переходит в богатый гликогеном многослойный плоский, покрывающий влагалищную порцию шейки матки и продолжающийся далее в составе слизистой оболочки стенки влагалища.
· Кисты Набота. В пубертатном периоде однослойный цилиндрический эпителий эндоцервикса переходит на влагалищную порцию шейки матки (зона трансформации). Под действием кислого (молочная кислота) содержимого влагалища (рН=3) происходит трансформация цилиндрического эпителия в многослойный плоский (плоскоклеточная метаплазия). При этом многослойный плоский эпителий экзоцервикса обрастает снаружи продуцирующий слизь однослойный эпителий, в результате чего под многослойным эпителием образуются кисты Набота.
· Рак шейки матки (плоскоклеточная карцинома) чаще всего возникает в зоне трансформации. Это одна из основных причин смертности от болезней злокачественного роста. Выявлена этиологическая роль вируса папилломы человека. Снижение летальности при раке шейки матки обусловлено внедрением в диагностику дисплазии и рака in situ метода исследования мазков по Папаниколау (Пап-мазок), где учитывается ядерно-цитоплазматический индекс. В нормальном мазке эпителиальные клетки имеют мелкое ядро при большом объёме цитоплазмы. Увеличение размеров ядра и уменьшение объёма цитоплазмы указывает на опухолевую трансформацию клеток.
Рис. 15-27. Влагалищная часть шейки матки. Слизистая оболочка канала шейки матки выстлана однослойным цилиндрическим эпителием. На поверхность открываются разветвлённые трубчатые железы. Вблизи наружного маточного зева однослойный цилиндрический эпителий переходит в многослойный плоский. [17]
Влагалище
Влагалище — фиброзно-мышечная трубка, состоящая из слизистой, мышечной и адвентициальной оболочек (рис. 15-28). Слизистая оболочка представлена многослойным плоским эпителием и собственным слоем, содержащего богатую сеть кровеносных сосудов. Многослойный плоский эпителий изнутри кнаружи состоит из базальных, промежуточных и поверхностных клеток. За счёт базальных (ростковых) клеток происходит постоянная регенерация пласта эпителия. Эпителий подвергается частичному ороговению (поверхностные клетки содержат гранулы кератогиалина). Рост и созревание эпителия находится под гормональным контролем. Эпителий истончен до менархе и после менопаузы, но становится толще в репродуктивном периоде. Кроме того, толщина эпителия зависит от стадии цикла. В собственном слое присутствуют лимфоциты, зернистые лейкоциты, иногда обнаруживаются лимфатические фолликулы. Во время менструации лейкоциты проникают в просвет влагалища. Мышечная оболочка состоит из двух слоёв ГМК и развитой сети эластических волокон. Внутренний тонкий слой содержит ГМК с циркулярной ориентацией. Наружный толстый слой образован продольными пучками ГМК. Адвентициальная оболочка образована волокнистой соединительной тканью и соединяет влагалище с окружающими структурами.
Вульвовагиниты — бактериальные (Gardnerella vaginalis), грибковые (Candida albicans) и протозойные (Trichomonas vaginalis) хронические инфекции. Эпителий влагалища служит надёжным барьером против инфекционных агентов, поэтому микроорганизмы проявляют свою жизнедеятельность в просвете влагалища.
Рис. 15-28. Стенка влагалища состоит из трёх оболочек: слизистой, мышечной и адвентициальной. В слизистой различают многослойный плоский эпителий и собственный слой. Мышечная оболочка образована внутренним циркулярным и наружным продольным слоями ГМК. Адвентициальная оболочка представлена волокнистой соединительной тканью. [17]
Менструальный цикл
Изменения гормонального фона (содержание в крови эстрогенов и прогестерона в разные дни овариального цикла, рис. 15-23) прямо влияют на состояние эндометрия, а также слизистой оболочки маточных труб, цервикального канала и влагалища. Эстрогены контролируют пролиферативную фазу менструального цикла (восстановление функционального слоя эндометрия), а прогестерон — секреторную фазу (подготовку эндометрия к имплантации, уменьшение порога возбудимости ГМК миометрия и поддержание тонуса ГМК шейки матки). Снижение содержания в крови эстрогенов и прогестерона сопровождается отторжением функционального слоя эндометрия и маточным кровотечением (менструальная фаза).
Эндометрий
Слизистая оболочка матки (рис. 15-29) подвергается циклическим изменениям (менструальный цикл). В каждом цикле эндометрий проходит менструальную, пролиферативную и секреторную фазы. В эндометрии различают функциональный и базальный слои. Базальный слой эндометрия кровоснабжается из прямых артерий и сохраняется в менструальную фазу. Функциональный слой эндометрия, отпадающий при менструации, кровоснабжается из спиральных артерий, склерозирующихся в менструальную фазу, вызывая ишемию функционального слоя.
Рис. 15-29. Маточные железы на различных фазах менструального цикла. Морфо-функциональное состояние маточных желёз зависит от фазы овариально-менструального цикла. При менструации маточные крипты разрушаются. В пролиферативную фазу за счёт сохранившихся эпителиальных клеток базального слоя происходит восстановление крипт. Железы имеют прямую трубчатую форму. Секреторная фаза характеризуется функциональной активностью маточных желёз. В начале секреторной фазы железы приобретают извилистый ход, в базальной части клеток накапливается гликоген. В поздней секреторной фазе железы расширяются, становятся более извилистыми, клетки приобретают секреторную активность. [17]
Менструальная фаза
Менструальная фаза — отторжение функционального слоя эндометрия. Если не произошло имплантации, менструальное жёлтое тело подвергается инволюции, а в крови резко снижается содержание гормонов яичника (прогестерона и эстрогенов). Это приводит к скручиванию, склерозированию и уменьшению просвета спиральных артерий, снабжающих кровью верхние две трети функционального слоя эндометрия. В результате происходит ухудшение кровотока в функциональном слое эндометрия. Развивающаяся ишемия приводит к отторжению функционального слоя и генитальному кровотечению. При менструации функциональный слой отторгается полностью, базальный слой эндометрия сохраняется. При длительности цикла 28 дней менструация в среднем продолжается 5±2 дня.
Пролиферативная фаза
Пролиферативная фаза следует за менструальной и длится до момента овуляции, т.е. до конца фолликулярной стадии цикла. В это время фоллитропин стимулирует рост и созревание фолликула и усиливает продукцию фолликулярными клетками эстрогенов. Под влиянием эстрогенов (в основном эстрадиола) происходят пролиферация клеток базального слоя и восстановление (регенерация) функционального слоя эндометрия. Эпителиальные клетки желёз базального слоя мигрируют на поверхность, пролиферируют и образуют новую эпителиальную выстилку слизистой оболочки. В эндометрии формируются новые маточные железы, из базального слоя врастают спиральные артерии. Длительность фазы может варьировать.
Секреторная фаза
Секреторная фаза продолжается от овуляции до начала менструации (12–16 дней). В эту фазу в яичнике функционирует жёлтое тело, вырабатывающее эстрогены и прогестерон. Высокий уровень прогестерона создаёт благоприятные условия для имплантации бластоцисты.
Маточные железы расширяются, становятся извилистыми. Железистые клетки прекращают деление, гипертрофируются и начинают секретировать гликоген, гликопротеины, липиды, муцин. Секрет поднимается к устью маточных желёз и выделяется в просвет матки.
Спиральные артерии приобретают более извитой характер и приближаются к поверхности слизистой оболочки.
Компактная и губчатая зоны функционального слоя. В поверхностных частях функционального слоя увеличивается количество соединительнотканных клеток, в цитоплазме которых накапливаются гликоген и липиды. Вокруг клеток формируются коллагеновые и ретикулиновые волокна, образованные коллагеном типов I и III. Клетки стромы приобретают черты децидуальных клеток плаценты. Благодаря таким изменениям эндометрия, в функциональном слое образуется две зоны: компактная (zona compacta), обращённая к просвету, и более глубокая — губчатая (zona spongiosa).
Миометрий. Прогестерон снижает порог возбудимости ГМК миометрия.
Регулярность цикла
Нормальная продолжительность цикла (от первого дня наступившей до первого дня следующей менструации) — 28±7 дней. Если не происходит оплодотворения и имплантации бластоцисты, текущий цикл завершает менструация, и начинаются события нового цикла. Этот биоритм сохраняется на протяжении всего репродуктивного периода. Беременность обрывает (точнее, блокирует) овариально-менструальный цикл. Как правило, менструальный цикл нерегулярен в течение двух лет после менархе (первая менструация) и в течение 3 лет перед менопаузой. В этих ситуациях часты ановуляторные циклы (овуляции не происходит).
· Менопауза (прекращение менструаций) наступает к 51 году, но нормально может произойти и в 40 лет. Ведущий механизм — уменьшение содержания эстрогенов в крови при увеличенном содержании гонадотропинов. Остеопороз — одно из серьёзных последствий снижения содержания эстрогенов.
· Аменорея. В эту группу расстройств включают состояния, при которых или не возникает менархе (первичная аменорея), или менструации прекращаются после менархе (вторичная аменорея).
à Первичная аменорея
Ä Дисгенезия гонад (синдром Тернера) встречается в 1 случае на 3000 новорождённых девочек. Причина — хромосомная аномалия (у больных Х-хроматин-негативный мазок слизистой оболочки десны и кариотип 45Х). Яичники отсутствуют, имеются только двусторонние тяжи соединительной ткани без зародышевых клеток. Дефицит эстрогенов, связанный с отсутствием ткани яичников, вызывает половой инфантилизм: не развиваются молочные железы, другие вторичные половые признаки.
Ä Синдром резистентных яичников. Неспособность яичников отвечать на стимуляцию гонадотропинами может быть как результатом аутоиммунного поражения яичников, так и дефекта рецепторов.
à Вторичная аменорея
Ä Гипоталамическая (психогенная, функциональная, идиопатическая) аменорея — наиболее частая форма. Уровни ЛГ и ФСГ в некоторых случаях низки, в других нормальны.
Ä Нарушение питания. Видимо, менархе наступает при достижении критической массы тела, а менструации часто прекращаются, когда женщина с нормальным ранее менструальным циклом худеет, её масса становится ниже критической вследствие голодания, хронического заболевания, стрессов, чрезмерного увлечения диетой или развития нейропсихической анорексии.
Ä Физическая активность. Аменорею наблюдают почти у 50% балерин и спортсменок. Частично за это ответственна потеря массы тела, связанная с тренировками; риск аменореи значительно выше у женщин, потерявших более 15% массы.
Ä “Аменорея после приёма таблеток” — задержка возобновления месячных более чем на 6 месяцев после прекращения применения пероральных контрацептивов.
Шейка матки
В собственном слое слизистой оболочки шейки матки отсутствуют спиральные артерии, поэтому в менструальную фазу слизистая оболочка шейки матки не отторгается подобно эндометрию тела матки. Вместе с тем в фолликулярную стадию цикла железы эндоцервикса продуцируют водянистый секрет, а в лютеиновую стадию цикла — вязкий слизистый секрет, заполняющий канал шейки матки наподобие пробки и препятствующий проникновению в матку сперматозоидов и микроорганизмов. В лютеиновую стадию прогестерон поддерживает тонус ГМК шейки матки.
Влагалище
Фолликулярная стадия. В начале стадии влагалищный эпителий тонкий и бледный. Под влиянием эстрогенов происходит пролиферация эпителия, который достигает своей максимальной толщины. В клетках накапливается значительное количество гликогена, используемого влагалищной микрофлорой. Образующаяся при этом молочная кислота препятствует развитию патогенных микроорганизмов. В эпителии появляются признаки частичной кератинизации.
Лютеиновая стадия. Рост и созревание эпителиальных клеток блокируется, на поверхности эпителия появляются лейкоциты и роговые чешуйки.
Беременность
Беременность прерывает стандартный ход овариально-менструального цикла. На разных сроках беременности вместе с развитием плаценты существенно изменяется эндокринный профиль. В плаценте вырабатывается гормоны и другие биологически активные вещества, имеющих важное значение для нормального протекания беременности и развития плода.
· Хорионический гонадотропин человека (ХГТ). ХГТ секретируется клетками трофобласта с момента имплантации бластоцисты в стенку матки. Появление в крови хорионического гонадотропина, сходного по своему действию с лютропином, стимулирует дальнейший рост жёлтого тела и усиливает продукцию эстрогенов и прогестерона, необходимых для сохранения беременности. Активность ХГТ, начиная примерно с 10-12-го дня после оплодотворения, быстро возрастает, удваиваясь каждые 2-3 дня. Пик концентрации ХГТ в крови достигает на 80-й день, затем несколько уменьшается и сохраняется на примерно одинаковом уровне до окончания беременности. С 28-го дня от начала беременности использование иммунологических методов позволяет обнаружить ХГТ в моче. В клинике ХГТ используют для индукции овуляции при ановуляторном овариальном цикле.
· Прогестерон. В поздней лютеиновой стадии в результате ХГТ-стимуляции жёлтого тела уровень прогестерона начинает медленно увеличиваться. Первые 6−8 недель беременности жёлтое тело — главный источник прогестерона. Начиная со второй трети беременности прогестерон вырабатывается клетками плаценты в количестве, которое обеспечивает нормальное протекание беременности. Жёлтое тело продолжает синтезировать прогестерон (особенно активно в первой половине беременности), но в последнем триместре беременности плацента вырабатывает в 30-40 раз больше прогестерона. Концентрация прогестерона в крови продолжает увеличиваться вплоть до конца беременности.
· Эстрогены. Для беременности характерен повышенный уровень циркулирующих эстрогенов. При этом эстриол составляет 90% всех эстрогенов. Эстриол — показатель нормальной жизнедеятельности плода.
· Пролактин. Во время беременности пролактин синтезируется в передней доле гипофиза матери и плода, плаценте. В материнском организме пролактин подготавливает молочные железы к лактации, у плода пролактин амниотической жидкости участвует в регуляции водно-солевого обмена.
· Хорионический соматомаммотропин 1 и 2, или плацентарный лактоген 1 и 2 синтезируется в синцитиотрофобласте. Может быть определён в сыворотке крови у беременной с 6 недель беременности. Его уровень постоянно возрастает в течение I и II триместров. Эстрогены и прогестерон в сочетании с пролактином, хорионическим соматомаммотропином у беременной стимулируют дифференцировку секреторных клеток молочной железы.
· Релаксин — гормон из семейства инсулинов, синтезируется клетками жёлтого тела и цитотрофобластом, в течение беременности оказывает расслабляющий эффект на миометрий, перед родами приводит к расширению маточного зева и уменьшению плотности лонного сочленения.
Наружные половые органы
Большие половые губы
Labia majora pudendi — две кожные складки по боковым сторонам половой щели. С наружной поверхности большие половые губы покрыты волосистой кожей с сальными и потовыми (эккриновыми и апокриновыми) железами. На внутренней поверхности волосяных фолликулов нет. В толще губ расположены венозные сплетения, жировая клетчатка и большие железы преддверия (glandulae vestibulares majores). Парные, большие железы преддверия находятся на границе передней и средней трети губ. Это разветвлённые секретирующие слизь трубчато-альвеолярные железы, открывающиеся в преддверие влагалища. Секрет с характерным запахом обычно выделяется при половом возбуждении и увлажняет поверхность преддверия и входа во влагалище.
Малые половые губы
Labia minora pudendi расположены кнутри от больших губ и скрыты последними. Малые половые губы лишены жировой ткани, но имеют многочисленные эластические волокна и богатое сосудистое сплетение. Пигментированная кожа содержит сальные железы и небольшие слизистые железы (glandulae vestibulares minores, малые железы преддверия), открывающиеся в преддверие влагалища.
Клитор
Clitor гомологичен дорсальной стороне полового члена, состоит из двух пещеристых тел (corpora cavernosa clitoridis), формирующих на дистальном конце головку (glans clitoridis). Клитор покрыт многослойным плоским эпителием со слабым ороговением; волосы, сальные и потовые железы отсутствуют. Кожа содержит многочисленные свободные и инкапсулированные нервные окончания.
Молочная железа
Молочная железа — производное эпидермиса и относится к железам кожи (рис. 15-30). Однако, развитие железы и её функциональная активность зависят от гормонов половой сферы.
Рис. 15-30. Лактирующая молочная железа состоит из 15–20 отдельных сложных трубчато-альвеолярных желёз, каждая из которых открывается собственным выводным протоком (молочный проток) на вершине соска. Сосок состоит из плотной соединительной ткани с большим содержанием эластических волокон и ГМК, располагающихся циркулярно в основании соска и параллельно молочным протокам. Кожа вокруг соска содержит крупные сальные железы, образующие возвышения (бугорки околососкового кружка). Молочные протоки под ареолой образуют молочные синусы, резервуары для молока. Пигментация эпидермиса соска происходит в пубертатном периоде, кожа ареолы пигментируется при беременности. [17]
Развитие
Железы закладываются как молочные линии — эпидермальные валики, залегающие с обеих сторон туловища от подмышечной области до паха. В средне-грудном отделе эпителиальные тяжи валиков врастают в собственно кожу и впоследствии дифференцируются в сложные трубчато-альвеолярные железы. Гистологическая картина молочной железы зависит от степени её зрелости и активности. Морфологические различия обнаруживаются в строении ювенильной железы, зрелой неактивной и зрелой функционирующей (лактирующей) желёз (рис. 15-31).
Строение
Ювенильная железа представлена выводными междольковыми и внутридольковыми протоками, разделёнными соединительнотканными перегородками; секреторные отделы отсутствуют.
Зрелая неактивная железа. При половом созревании под влиянием эстрогенов железа увеличивается в объёме. Выводные протоки становятся более разветвлёнными, а среди соединительнотканных перегородок накапливается жировая ткань. Секреторные отделы, как и в ювенильной железе, отсутствуют.
Рак молочной железы у женщин занимает по частоте первое место. Заболевание можно классифицировать по наличию или отсутствию рецепторов эстрогенов и прогестерона: рецептор-позитивные опухоли чаще встречают в постменопаузе, характеризуются благоприятным прогнозом. Рецептор-негативные опухоли чаще встречают в пременопаузе. Часть семейных форм рака обусловлена передачей мутантых форм гена BRCA1, кодирующего регуляторный белок клеточного цикла.
Рис. 15-31. Гормональный контроль развития и функции молочной железы. Эстрогены, гормон роста, пролактин, глюкокортикоиды стимулируют развитие выводных протоков в ювенильной и в зрелой неактивной молочных железах. Впервые секреторные отделы появляются на третьем месяце беременности. У беременной хорионический соматомаммотропный гормон индуцирует дифференцировку альвеолярных клеток. [17]
Лактирующая железа. Под влиянием прогестерона в сочетании с эстрогенами, пролактином и хорионическим соматомаммотропным гормоном индуцируется дифференцировка секреторных отделов молочной железы. Уже на третьем месяце беременности из растущих концевых отделов внутридольковых протоков формируются почки, дифференцирующиеся в секреторные отделы — альвеолы (рис. 15-31А). Альвеолы выстланы кубическими секреторными клетками (альвеолярные клетки). Снаружи стенку альвеол и выводных протоков окружают миоэпителиальные клетки. Внутридольковые протоки выстланы однослойным кубическим эпителием, который в молочных протоках переходит в многослойный плоский. Соединительнотканные перегородки, разделяющие дольки молочной железы, становятся менее выраженными.
Рис. 15-31А. Лактирующая молочная железа. Дольки железы разделены соединительнотканными перегородками. Концевые секреторные отделы (альвеолы) выстланы железистыми клетками кубической формы (лактоцитами). Окраска гематоксилином и эозином.
· Молозиво. В первые 2–3 дня после родов молочная железа вырабатывает молозиво (colostrum). В отличие от молока, colostrum содержит больше белка, но меньше углеводов и жиров. Кроме того, в молозиве обнаруживаются клеточные фрагменты, а также целые клетки, содержащие жир, — молозивные тельца.
· Молоко. После рождения ребёнка в крови матери резко снижается уровень эстрогенов и прогестерона. Это позволяет пролактину инициировать секрецию молока альвеолярными клетками. В период лактации альвеолярные клетки секретируют жиры, казеин, a-лактоальбумин, лактоферрин, сывороточный альбумин, лизоцим, лактозу. В состав молока также входят вода, соли, АТ. IgA из крови при помощи специфических рецепторов захватываются альвеолярными клетками и выделяются в просвет секреторного отдела железы. Материнские АТ обеспечивают гуморальный иммунитет новорождённого.
· Секреция. Молоко секретируется по апокриновому типу. Жиры высвобождаются вместе с фрагментами клеточной мембраны, остальные компоненты молока выделяются путём экзоцитоза.
Нервно-гуморальная регуляция секреции молока
Во время кормления ребёнка раздражение нервных окончаний соска молочной железы передаётся по афферентным нервным волокнам в гипоталамус (рис. 15-32). Афферентные импульсы стимулируют нейросекреторные клетки околожелудочковых и надзрительных ядер к выделению окситоцина и пролактина.
Окситоцин вызывает сокращение миоэпителиальных клеток и тем самым способствует продвижению молока в выводные протоки. У кормящих матерей спонтанная секреция окситоцина происходит также во время игры с ребёнком или при его плаче.
Пролактин поддерживает лактацию. Под влиянием пролактина в мембране альвеолярных клеток увеличивается плотность рецепторов как к пролактину, так и к эстрогенам. Секреция пролактина происходит во время кормления ребёнка. В течение получаса в крови резко увеличивается концентрация пролактина, что стимулирует секреторную активность альвеолярных клеток и способствует накоплению молока для следующего кормления.
Эстрогены усиливают секрецию пролактина путём повышения чувствительности лактотрофов к тиролиберину и снижения — к дофамину.
Дофамин, секретируемый нейроэндокринными клетками срединного возвышения гипоталамуса, блокирует секрецию пролактина лактотрофами аденогипофиза. Чувствительные нейроны при раздражении нервных окончаний соска во время кормления активируют нейроны спинного мозга, ингибирующие секрецию дофамина. Снижение уровня дофамина в портальных сосудах гипоталамо-гипофизарной системы облегчает секрецию пролактина, активирующего лактацию. Лактация может продолжаться так долго, как долго ребёнок будет сосать грудь (вызывать раздражение нервных окончаний соска молочной железы).
Гонадолиберин. На фоне лактации подавляется секреция гонадотропных гормонов. Это связано с активацией нейронов спинного мозга, блокирующих высвобождение гонадолиберина нейросекреторными клетками гипоталамуса.
Рис. 15-32. Механизмы регуляции секреции молока. В ответ на раздражение нервных окончаний соска блокируется секреция дофамина и гонадолиберина. Одновременно усиливается секреция пролактина и окситоцина. Пролактин стимулирует продукцию молока альвеолярными клетками в перерывах между кормлениями. Окситоцин вызывает сокращение миоэпителиальных клеток во время кормления, что способствует выделению молока. [114]